Презентация на тему: Эволюция учения об атоме

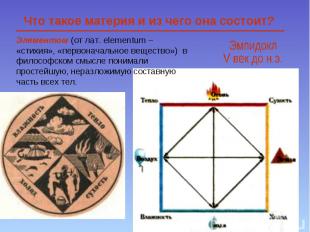
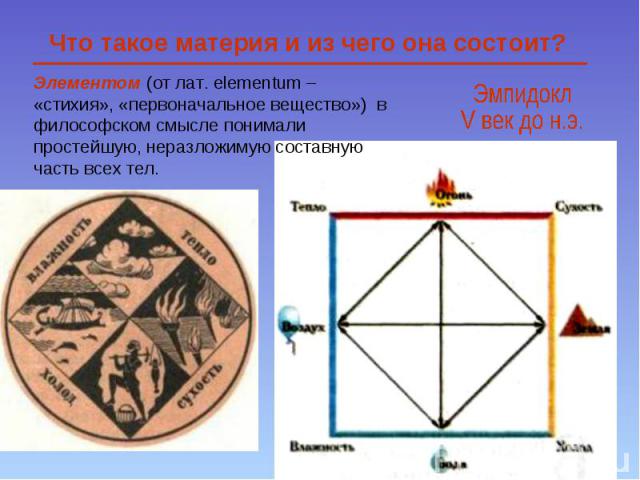
Элементом (от лат. еlementum – «стихия», «первоначальное вещество») в философском смысле понимали простейшую, неразложимую составную часть всех тел. Что такое материя и из чего она состоит?

Материя – дискретна «Существует предел деления вещества -атом» Материя – непрерывна «Делимость вещества бесконечна» Атом в переводе на русский – неделимый

все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов; атомы непрерывно двигаются в пустоте; никто их не создавал, они были всегда; никто не может уничтожить атомы; атомы материальны: имеют вес, размеры, форму; одни атомы имеют крючочки, другие петельки с помощью которых соединяются друг с другом.

Элементы мира – правильные многогранники: тетраэдр - «частица огня», октаэдр - «частица воздуха», икосаэдр - «частица воды», куб - «частица земли». «ТИМЕЙ»: В основе всего сущего лежат частицы. Эти частицы имеют форму геометрических фигур – треугольников.

В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.

После 10 лет эксперимента Р. Бойль написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.

«Химик без знания физики, — писал он,-- подобен человеку, который всего должен искать ощупом. И сии две науки так соединены между собой, что одна без другой в совершенстве быть не могут». М. В. Ломоносова по праву считают основоположником количественного метода исследования. Все происходящие в природе химические и физические явления обусловлены внутренним движением частиц вещества. Наделив атомы массой, шарообразной формой и способностью к движению, ученый высказал ряд важных положений, которые спустя 130 лет легли в основу молекулярно-кинетической теории газов.

А. Лавуазье описал и систематизировал все известные в то время химические элементы. В 1789 г. ученый опубликовал ставший знаменитым «Элементарный учебник химии», в котором блестяще обобщил все достижения химии того времени.

Новая эпоха начинается в химии с атомистики (следовательно, не Лавуазье, а Дальтон — отец современной химии) Ф. Энгельс Для объяснения имеющихся экспериментальных данных Д. Дальтон наделил атомы тремя свойствами: атомы неизменны и неделимы (обоснование закона сохранения массы веществ при химических реакциях); все атомы одного и того же элемента тождественны (обоснование закона постоянства состава); атомы способны соединяться между собой в различных соотношениях (обоснование закона кратных отношений) Д. Дальтон предложил рассчитывать относительные атомные массы, приняв массу атома водорода за единицу. На основании данных химического анализа различных соединений он вычислил относительные атомные массы девятнадцати элементов.

В 1808 г. французский исследователь Жозеф Луи Гей-Люссак сообщил об открытии закона простых объемных отношений.

На основе закона простых объемных отношений Авогадро выдвинул гипотезу: 1. Атомы одного и того же элемента могут соединяться в молекулы; 2. В равных объемах любых газов содержится равное число молекул. А. Авогадро установил двухатомность молекул кислорода, водорода, азота, хлора и правильный состав молекул воды Н20, метана СН4, этилена С2Н4. Однако гипотеза Авогадро не была понята его современниками.

В 1860 году состоялся I Международный конгресс химиков. Участники конгресса: - четко разграничили понятия атома и молекулы, - установили единую химическую терминологию - приняли новую систему атомных масс, в основе которой лежала гипотеза Авогадро. Достигнутое учеными различных стран единство взглядов по основным спорным вопросам того времени явилось главной предпосылкой возникновения периодической системы элементов.

Основываясь на том, что атомная масса водорода почти в точности равна единице и что атомные массы других элементов тоже приближаются к целым числам, У. Проут выдвинул гипотезу о происхождении всех химических элементов из водорода. Н А(Н)=1

Первая попытка научной классификации химических элементов принадлежит немецкому химику Иоганну Вольфгангу Доберейнеру, который сгруппировал некоторые сходные между собой элементы в порядке увеличения их атомных масс. Конечным результатом его исследований была опубликованная в 1829 г, таблица «триад»:




В 1871 г. ученый разработал новый вариант периодической системы, который уже мало чем отличался от современного.

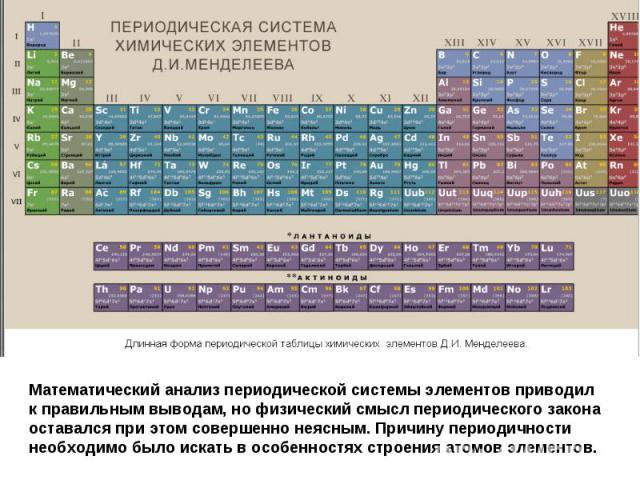
Логическим завершением поисков различных вариантов научной систематики химических элементов явилась периодическая система Дмитрия Ивановича Менделеева, составленная русским ученым в феврале 1869 г. при написании учебника по химии для студентов Петербургского университета.

Периодическая таблица химических элементов, созданная на основе периодического закона, открытого русским ученым ДИ Менделеевым стала научным венцом атомной химии.
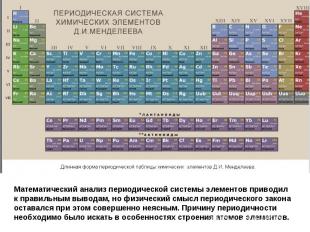
Математический анализ периодической системы элементов приводил к правильным выводам, но физический смысл периодического закона оставался при этом совершенно неясным. Причину периодичности необходимо было искать в особенностях строения атомов элементов.

В 1885 г. шведский исследователь Иоганн Роберт Ридберг подвел математический фундамент под периодический закон: 1) У= f(А) у — некоторое свойство элемента; А — его атомная масса; f(x)—периодическая функция. 2) атомная масса А также есть функция некоторого числа N, которое ученый назвал порядковым числом элемента. А= f(N) 3) Формула нахождения атомных масс A=N1,21

Ярым противником атомно-молекулярного учения в конце XIX в. выступил известный немецкий естествоиспытатель Вильгельм Оствальд. Он утверждал, что атомы и молекулы существуют только в сознании человека и что атомистические представления — всего лишь удобный способ отображения реально протекающих во времени и в пространстве энергетических процессов. Он настаивал, чтобы химики по возможности не пользовались атомистической теорией.

Разрешить спор между сторонниками и противниками атомно-молекулярного учения мог только эксперимент. И такой эксперимент был вскоре поставлен. И открытия не заставили себя ждать.