Презентация на тему: Элементы

Лекция 8 Периодический закон 900igr.net

История создания периодической системы В истории каждого научного открытия можно определить два основных этапа: 1) установление частных закономерностей; 2) сам факт открытия и признания этого открытия. До того как Д.И. Менделеев сформулировал периодический закон и предложил его графическое изображение (периодическую систему ) существовали и другие попытки систематизировать знания о свойствах элементов. Ученые предлагали свои таблицы и графики элементов. Некоторые из ученых утверждали, что именно им принадлежит право первенства открытия. Поэтому познакомимся с некоторыми главными идеями предшественников открытия периодического закона.

Закон триад Начало 19 века Дж. Дальтон (основатель атомистики) ввел важнейшую характеристику элементов – атомный вес (позже атомная масса). Это понятие позволило изучать и определять важнейшую характеристику – количественный состав простых и сложных тел. Первым, кто применил количественные характеристики элементов был немецкий ученый Иоганн Вольфганг Деберейнер (1780 – 1849).

В 1829 г он опубликовал таблицу, в которой в группы по 3 элемента объединялись элементы со сходными свойствами. Помимо химического сходства наблюдается и закономерность в отношении масс атомов. Например: 7Li, 23Na, 39K; 40Ca, 88Sr, 137Ba Закон триад: атомная масса среднего элемента равна среднему арифметическому атомных масс двух крайних элементов Ar(Na)= (Ar(Li)+ Ar(K))/2=(7+39)/2=23

Позднее ученые Макс Петтенкофер (1850) и Жан Батист Дюма (1857) объединили большее число элементов в триады.

Винтовая линия Шанкартуа 1862 г. французский ученый Александр Эмиль Бетье де Шанкуртуа предложил систему элементов в виде графика. Он разместил все известные элементы в порядке увеличения массы атомов по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Однако эта схема не получила конкретного анализа и развития, не указывала точное место элемента в системе.

Закон октав 1863 – Джон Александер Рейна Ньюлендс. Английский химик. Если сходные элементы расположить друг за другом, то каждый восьмой элемент располагается под первым, свойства элементов повторяются подобно октавам в музыке. В таком графическом изображении без пропусков исключалась возможность открытия новых элементов, кроме того многие элементы попадали на несоответствующие им места.

Таблица Мейера 1864 – немецкий ученый Юлиус Лотар Мейер Расположил 44 элемента из известных 62-х в шести столбцах в соответствии с их валентностью по водороду. Однако эта таблица не отражала периодичности свойств. В 1870 г. статья «Природа химических элементов как функция их атомных весов», приведена графическая зависимость атомных объемов от атомных масс (кривая Мейера).

Периодический закон и его графическое отображение 1869 – русский ученый Д.И.Менделеев открыл периодический закон и опубликовал свой первый вариант периодической системы химических элементов «Опыт системы элементов основанный на их атомном весе и химическом сходстве». В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет Менделеев продолжает творческую разработку таблицы. Д.И. Менделеев неоднократно подчеркивал значение тех трудов, которые побуждали его к исканиям: «…Я пользовался прежними исследованиями Дюма, Гладстона, еттенкофера, Кремерса и Ленссена» «Я считаю, что обязан преимущественно двум: Ленссену и Дюма. Я изучил их исследования и они побудили меня искать действительный закон» Д.И. Менделеев. Собр. со.ч., т.2,1934,стр.288 и 321

Формулировка периодического закона Д.И Менделеева Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
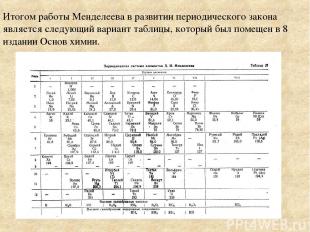
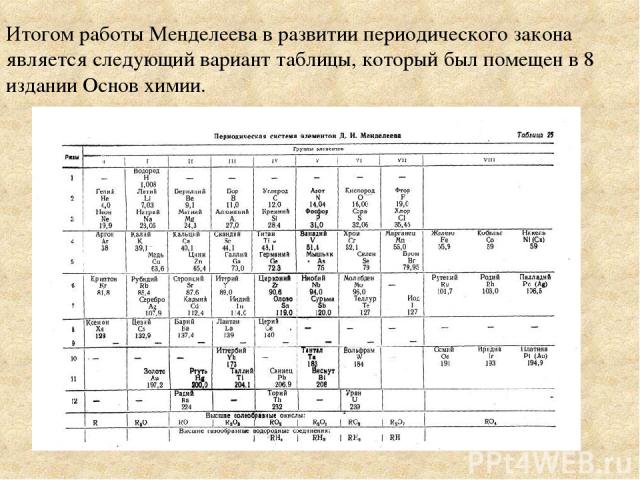
Итогом работы Менделеева в развитии периодического закона является следующий вариант таблицы, который был помещен в 8 издании Основ химии.

Значение периодического закона Периодическая система элементов явилась одним из наиболее ценных обобщений в химии. Она представляет собой как бы конспект химии всех элементов, график по которому можно читать свойства элементов и их соединений. Система позволила уточнить положение, величины атомных масс, значение валентности некоторых элементов. На основе таблицы можно было предсказать существование и свойства еще не открытых элементов. Менделеев предсказал и описал свойства не открытых в то время элементов, которые он назвал экабор (скандий), экаалюминий (галий), экасилиций (германий). Менделеев сформулировал периодический закон и предложил его графическое отображение, однако в то время нельзя было определить природу периодичности. Не была вскрыта причина периодичности изменения свойств и их соединений.Смысл периодического закона был выявлен позднее, в связи с открытиями по строеию атома.
Открытия, позволившие развить периодический закон 1875 – французкий ученый П.Э. Лекок де Буабодран открыл новый элемент галий.

1879 – шведский ученый Ларс Фредерик Нильсон окрыл новый элемент скандий. 1886 – немецкий ученый Клеменс Александр Винклер –открыл элемент германий. германиевый диод

1893-1898 – английский ученый Уильям Рамзай открыл сначала инертный газ аргон, а позже и остальные.

Закон Мозли Однако несмотря на огромное естественнонаучное значение открытия периодического закона физический смысл обобщенных Д.И.Менделеевым фактов долгое время оставался непонятным (из-за отсутствия в 19 веке каких-либо представлений о сложности строения атома). Например, почему элемент калий(А=39,1) в таблице находится после аргона (А=39,9); никель (58,7) после кобальта (58,9); йод(126,9) после теллура (127,6). Менделеев отступил от принятого им порядка, исходя из свойств данных элементов, требовавших именно такого расположения. Таким образом он не придавал исключительного значения атомной массе, а руководствовался совокупностью свойств. Развитие теории строения атома доказало верность размещения этих элементов.

1913 – английский физик Генри Мозли на основании экспериментальных данных (исследование рентгеновских спектров химических элементов) установил, что порядковый номер элемента совпадает с зарядом ядра атома Периодическое изменение свойств элементов зависит от их порядкового номера.

Современная формулировка периодического закона Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов. А точнее свойства химических элементов определяются периодически повторяющимися однотипными электронными конфигурациями

Структура периодической системы химических элементов Д.И. Менделеева Период – горизонтальный ряд элементов, расположенных в порядке возрастания порядкового номера от первого s-элемента (ns1) до шестого p-элемента(ns2np6) Каждый период начинается активным щелочным металлом и заканчивается инертным газом Периоды: 1) малые – 1-й (2 элемента), 2-й и 3-й(8 элементов) 2) большие – 4-й, 5-й (18 элементов) 6-й (32 элемента) 7-й (19 элементов, незавершенный) Состоят из 2-х рядов: четный содержит только металлы; нечетный содержит металлы и неметаллы

Группы – вертикальные ряды. Номер группы определяет максимальную валентность элемента, максимальную положительную степень окисления, число валентных электронов (исключения кислород и фтор) Группы делятся на подгруппы. Подгруппа – это вертикальный ряд элементов, имеющих однотипное электронное строение и являющихся электронными аналогами. Главные подгрупы (А-подгруппы)- содержат элементы s- и p-электронных семейств, которые расположены и в больших и в малых периодах. s-элементы только металлы p-элементы металлы и неметаллы. Побочные подгруппы(В-подгруппы) содержат элементы d-электронных семейств. В побочных подгруппах элементы только больших периодов, только металлы.

Порядковый номер, массовое число. Из закона Мозли следует, что порядковый номер элемента соответствует положительному заряду ядра атома. Атом характеризуют три фундаментальных элементарных частицы. Протон, нейтрон, электрон. Ядро заряжено положительно и в нем сосредоточена основная масса. Ядро состоит из протонов и нейтронов. Сумма количества протонов и нейтронов МАССОВОЕ ЧИСЛО – А. A= N(11p)+ N(10n)

А соответствует относительной атомной массе элемента,которые приведены в п.с.: A=Ar . Число протонов равно порядковому номеру: N(11p)=Z Число нейтронов: N(10n)= A- Z Число электронов равно заряду ядра число электронов равно порядковому номеру: N(e)=Z
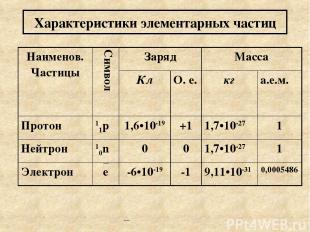
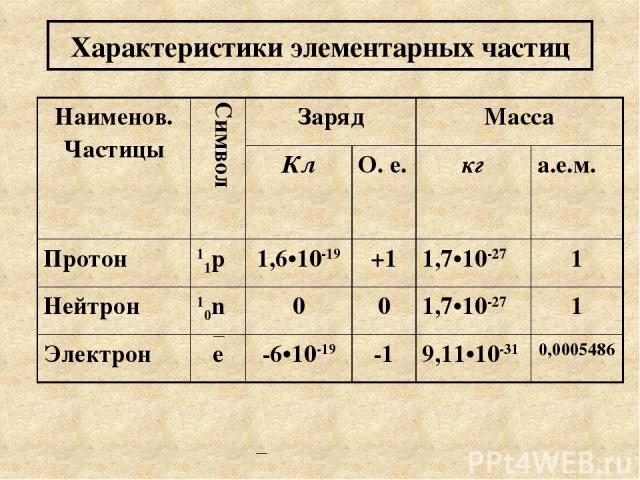
Характеристики элементарных частиц Наименов. Частицы Символ Заряд Масса Кл О. е. кг а.е.м. Протон 11p 1,6•10-19 +1 1,7•10-27 1 Нейтрон 10n 0 0 1,7•10-27 1 Электрон e -6•10-19 -1 9,11•10-31 0,0005486

Изотопы Атомы одного элемента, имеющие одинаковый заряд ялра, но разные массовые числа называются изотопами. Изотопы содержат одинаковое число протонов, но разное число нейтронов. Примеры: 11Н – протий, 21Н-дейтерий 31Н-тритий 3517Cl (77,3%), 3717Cl (22,7%) Ar(Cl)=(35•77,3+37 •22,7)/100=35,454-относительная атомная масса – среднее арифметическое масс изотопов с учетом их % содержания

Периодическая система и строение атомов. В настоящее время периодическую систему элементов Менделеева можно рассматривать как классификацию атомов по строению их электронной оболочки. Таблица дает исчерпывающую информацию о разнообразии и подобии в строении электронной оболочки, а следовательно классификацию элементов по строению их атомов. Физико-химические свойства элементов тесно связаны со строением электронной оболочки атома, следовательно таблица представляет классификацию элементов и по физико-химическим свойствам.

Классификация атомов По способу застраивания электронной оболочки s- элементы заполняется s-подуровень наружного слоя. Внутренние электронные слои остаются неизменными.Это два первые элемента любого периода p-элементы заполняется р-подуровень наружного слоя Внутренние электронные слои остаются неизменными.Это шесть последних элементов периода (кроме 7-го)

d – элементы. Застраивается соседний с наружным уровень. В наружном слое этих элементов на s-подуровне находится чаще 2 реже 1 электрон. Таких элементов по 10 в каждом большом периоде (кроме 7-го) f – элементы. В атомах этих элементов заполняется f-подуровень третьего уровня, считая от внешнего. Сейчас известно 28 таких элементов. Они делятся на два семейства лантаноидов (заполняется 4f-подуровень) и актиноиды (заполняется 5f-подуровень.

2. По числу электронов в наружном квантовом слое электронной оболочки металлы – все элементы в наружном квантовом слое которых 1-3 электрона (кроме водорода, бора, гелия). Могут только отдавать электроны, поэтому не образуют отрицательно заряженных ионов. К ним относятся s-, некоторые p-, а также d-,f-элементы. d-,f-металлы могут проявлять переменную степень окисления. Максимальная положительная степень окисления равна номеру группы в которой находится элемент.

Неметаллы – элементы наружный слой которых содержит 4 - 7 электронов, а также водород и бор. Неметаллы способны как принимать так и отдавать электроны. Поэтому могут проявлять как отрицательные, так и положительные степени окисления. Однако тенденция к приему электронов у них выражена сильнее. Все неметаллы кроме водорода относятся к р-элементам. Инертные (благородные) газы – элементы в наружном слое которых находится 8 (р-элементы :неон, аргон, криптон, ксенон, радон) или 2 электрона (гелий s-элемент)

Некоторые характеристики атома и свойства элементов Периодичность накопления электронов около ядра приводит к периодичности в изменении свойств атомов элементов. Периодически изменяются такие характеристики атомов, как валентность, объемы атомов, радиусы атомов и ионов, энергии ионизации, восстановительные свойства, энергии сродства к электрону, окислительные свойства, электроотрицательности, некоторые физические свойства (температуры плавления и кипения и др.). Понятие валентность более подробно рассмотрим позже. Перейдем к рассмотрению других характеристик.

Атомные объемы Атомный объем – объем, занимаемый одним молем атомов простого вещества в твердом состоянии. Дает четкое представление о периодичности изменения физических свойств простых веществ. Впервые графическую зависимость между величинами атомных масс и атомных объемов предложил Мейер. Наибольший атомный объем имеют щелочные металлы.

Радиус атома (радиус Слейтера) – расстояние от ядра атома до максимума электронной плотности его валентных электронов Обозначение r. Размерность пм (пикометр – 10-12м) или нм (нанометр – 10-9м) Радиус атома rан >rат> rкат
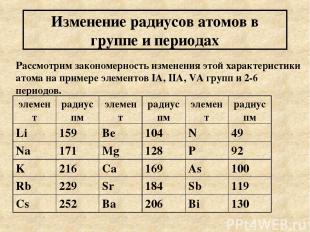
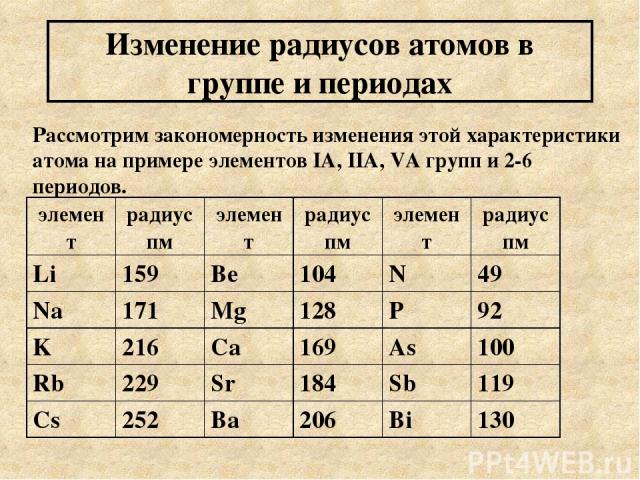
Изменение радиусов атомов в группе и периодах Рассмотрим закономерность изменения этой характеристики атома на примере элементов IA, IIA, VA групп и 2-6 периодов. элемент радиус пм элемент радиус пм элемент радиус пм Li 159 Be 104 N 49 Na 171 Mg 128 P 92 K 216 Ca 169 As 100 Rb 229 Sr 184 Sb 119 Cs 252 Ba 206 Bi 130

Выводы из таблицы: 1) в группе сверху вниз радиус атома увеличивается. Число электронов остается постоянным равным номеру группы. Чем меньше электронов на внешнем уровне и чем дальше эти электроны находятся от ядра, тем слабее электростатические силы между «+» ядром и электронами легче атом элемента отдает эти электроны. Элементы легко отдающие электроны проявляют металлические свойства, восстановительные свойства. Их оксиды и гидроксиды проявляют основные свойства (реже амфотерные) 2) В периоде слева направо радиус атома уменьшается, т.к. число энергетических уровней в пределах одного периода постоянно, но увеличивается число электронов на внешнем уровне. Следовательно электростатическое взаимодействие между «+» ядром и электронами усиливается, а радиус уменьшается (эффект р-сжатия). В связи с этим элементы конца периода будут легче принимать электроны. Такие элементы проявляют неметаллические и окислительные свойства. Их оксиды носят кислотный характер

Энергия ионизации Определение: энергия ионизации – энергия, неоходимая для превращения нейтрального атома в положительно заряженный ион. Или это энергия которую необходимо затратить для отрыва электрона от электронейтралього атома : Э0 - е Э+ . rкат.
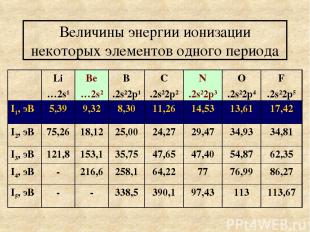
Величины энергии ионизации некоторых элементов одного периода Li …2s1 Ве …2s2 В .2s22p1 С .2s22p2 N .2s22p3 O .2s22p4 F .2s22p5 I1, эВ 5,39 9,32 8,30 11,26 14,53 13,61 17,42 I2, эВ 75,26 18,12 25,00 24,27 29,47 34,93 34,81 I3, эВ 121,8 153,1 35,75 47,65 47,40 54,87 62,35 I4, эВ - 216,6 258,1 64,22 77 76,99 86,27 I5, эВ - - 338,5 390,1 97,43 113 113,67

Выводы из таблицы Общая тенденция: 1) в периоде с увеличением заряда ядра, уменьшается радиус энергия ионизация увеличивается. Наименьшее значение энергии ионизация у элемента лития, наибольшее у фтора. Следовательно наибольшей восстановительной активностью характеризуются щелочные металлы. 2) Отрыв каждого следующего электрона требует большей затраты энергии. Особенно резко возрастает энергия ионизации при переходе к другому электронному слою.

Исключения : элементы бериллий и азот. Энергии ионизации бериллия выше, чем у соседних бора и углерода. То же справедливо для азота. Это объясняется следующим правилом: наиболее устойчивы электронные конфигурации атомов элементов с полностью или наполовину заполненным подуровнем. Электронные конфигурации Бериллия 1s22s2 Азот 1s22s22p3

Энергия сродства к электрону Определение: энергия, которая выделяется (реже поглощается) при присоединении электрона к атому. Э0+е Э- rат.

Выводы Характер изменения энергии сродства к электрону в группе: в группе сверху вниз увеличивается радиус атома, силы электростатического взаимодействия «+» заряженного ядра и внешних электронов ослабевают, поэтому энергия сродства к электрону уменьшается. В периоде слева направо уменьшается радиус атома, количество электронов на внешнем уровне увеличивается, поэтому энергия сродства к электрону тоже увеличивается.

Электроотрицательность Определение: электроотрицательность – способность атома притягивать к себе электроны в химическом соединении. Определяется как полусумма энергии ионизации и сродства к электрону: ЭО= (I+E)/2 (шкала Р. Малликена). Недостаток – нет надежных методов определния Е. На практике пользуются относительными значениями электроотрицательности. Величины приводятся в таблицах. Существует несколько шкал ОЭО. Мы будем пользоваться значениями ОЭО по Полингу. Характер изменения ОЭО аналогичен уже рассмотренным характеристикам. За единицу принята ОЭО лития. Самая высокая ОЭО у фтора. По величине ОЭО можно судить о свойствах элемента, его заряде в соединении, типах связи.

Общие выводы по теме На основании энергетических характеристик атомов элементов, энергетически устойчивы электронные конфигурации с полностью или наполовину заполненными подуровнями. В связи с этим для ряда элементов наблюдается провал электрона с текущего уровня на предыдущий. Например: для элементов подгруппы меди наблюдается провал электрона с текущего ns-подуровня на (n-1)d-подуровень. Аналогичное явление наблюдается для элементов хрома и молибдена.

Электронные конфигурации этих элементов: Cu - …3d104s1; Ag - …4d105s1; Au – 5d106s1; Cr - …3d54s1; Mo - …4d55s1

2. С увеличением заряда ядра и количества электронов во внешнем уровне изменение свойств химических элементов не совершается непрерывно в одном и том же направлении (от типично металлических до неметаллических), а имеет периодический характер. Таким образом элементы выделены в электронные аналоги. Электронные аналоги имеют общее строение валентных подуровней, а следовательно общую электронную формулу. Общую формулу и общие свойства оксидов и т.д. 3.Свойства и характеристики атомов элементов изменяются в известной последовательности как в горизонтальном, так и в вертикальном направлениях. Изменение некоторых свойств и характеристик по таблице Д.И.Менделеева приведено на следующем слайде 4. На основании положения элемента в п.с. можно дать его характеристику и характеристику его соединений.

Изменение некоторых характеристик атомов и свойств элементов в периодической системе Д.И. Менделеева Уменьшение радиуса атома Увеличение значений энергий ионизации, сродства к электрону, ОЭО Усиление неметаллических и окислительных свойств элементов Ослабление основных свойств оксидов Уменьшение температур кипения и плавления простых веществ.

Подгруппы аналогов Подгруппа щелочных металлов. Общая электронная формула …ns1. Возбужденного состояния нет. Максимальная степень окисления +1. Общая формула оксидов Ме2О. Водородные соединения МеН-гидриды. 2. Подгруппа бериллия. Общая электронная формула …ns2. Возбужденное состояние есть. Максимальная степень окисления +2. Общая формула оксидов МеО. Водородные соединения МеН2-гидриды. 3.Подгруппа бора. Общая электронная формула …ns2np1. Возбужденное состояние есть. Максимальная степень окисления +3. Общая формула оксидов Э2О3. Бор – неметалл. Простейшее водородное соединение ВН3-бороводород. Остальные элементы металлы. Водородные соединения МеН3-гидриды

4. Подгруппа углерода. Общая электронная формула …ns2np2. Возбужденное состояние есть. Максимальная степень окисления +4. Минимальная степень окисления –4. Общая формула оксидов ЭО2. Формула водородных соединений ЭН4 5. Подгруппа азота. Общая электронная формула …ns2np3. Возбужденное состояние есть (исключение азот). Максимальная степень окисления +5. Минимальная степень окисления –3. Общая формула оксидов Э2О5. Формула водородных соединений ЭН3 6. Подгруппа кислорода. Общая электронная формула …ns2np4 Возбужденное состояние есть (исключение кислород). Максимальная степень окисления +6 (исключение кислород). Минимальная степень окисления –2. Общая формула оксидов ЭО3. Формула водородных соединений Н2Э

7. Подгруппа галогенов (фтора). Общая электронная формула …ns2np5. Возбужденное состояние есть (исключение фтор). Максимальная степень окисления +7. Минимальная степень окисления –1. Общая формула оксидов Э2О7. Формула водородных соединений НЭ. К этой же подгруппе следует отнести и водород, т.к. его свойства схожи с галогенами,в частности в соединениях с металлами он проявляет степень окисления –1. Соединения водорода с металлами относятся к солеподобным. d-элементы не имеют аналогов в 1-3 периодах. Для них неизвестна отрицательная степень окисления. Валентные электроны располагаются на внешнем s-подуровне и соседним с внешним d-подуровне. В возбужденное состояние могут переходить только электроны с внешнего s- на внешний р-подуровень. Всего подгрупп аналогов 10. Рассмотрим некоторые из них.

Подгруппа скандия Sc, Y, La, Ac. Общая электронная формула ns2(n-1)d1. Максимальная степень окисления +3. Возбужденное состояние есть. Формула высшего оксида Ме2О3. Подгруппа титана Ti, Zr, Hf. Общая электронная формула ns2(n-1)d2. Максимальная степень окисления +4. Возбужденное состояние есть. Формула высшего оксида МеО2. Подгруппа марганца Mn,Te, Re. Общая электронная формула ns2(n-1)d5. Максимальная степень окисления +5. Возбужденное состояние есть. Формула высшего оксида Ме2О7. Подгруппа меди Сu, Ag, Au. Общая электронная формула ns1(n-1)d10! Возможные степени окисления +1,+2,+3. Это можно объяснить нестабильностью d-подуровня. Возбужденного состояния нет. Формула высшего оксида Ме2О, МеО, Ме2О3.

Положение в п.с. (порядковый номер, период, подгруппа). 2. Характеристика атома элемента. Заряд ядра Z, число протонов Nр, число нейтронов Nn, число электронов Ne. Полная электронная формула. Графическая электронная конфигурация валентных уровней в нормальном и возбужденном состояниях. Характеристика элемента по его положению в периодической системе.

3. Электронное семейство к которому относится элемент, металл или неметалл, формула и характер высшего оксида (основной, амфотерный, кислотный) и соответствующего ему гидрата. Реакции подтверждающие свойства оксида и гидрата.

Примеры Дайте характеристику элемента № 56 по положению в п.с. Элемент №56 – барий 56Ва. Ва находится в 6 периоде во второй группе главной подгруппы. 2) Z=+56, N(11p)=56, N(e)=56, N(10n)=A-N(11p)=137-56=81 Электронная формула: 1s22s22p63s23p64s23d104p65s24d105p66s2

Основное состояние: …6s26р0 В(Ва)=0 Возбужденное состояние …6s16р1 В(Ва*)=2 3. Ва – s-элемент, металл, ОЭО=0,9. Высший оксид ВаО – основной. Гидрат – Ва(ОН)2-основание ВаО+Н2О=Ва(ОН)2; ВаО+СО2= ВаСО3; ВаО+2HCl=BaCl2+ Н2О;

Ba(OH)2+2HCl=BaCl2+ Н2О Ba(OH)2+CO2= BaCO3 + Н2О Ba(OH)2 +K2SO4= BaSO4 + 2KOН 2.Дайте характеристику элемента №6, 16, 17, 25, 74 по положению в п.с.

Проверочная работа Что общего для элементов 5 периода А) число валентных электроно равно 5 Б) Число энергетических уровней равно 5 В) главное квантовое число равно 5 2. Запишите электронную формулу для атома бора (5В). Распределите электроны по квантовым ячейкам в возбужденном состоянии

http://margo1.nm.ru