Презентация на тему: Электрический ток в растворах и расплавах электролитов

Электрический ток в растворах и расплавах электролитов.

Электролиты вещества, растворы и расплавы которых обладают ионной проводимостью.
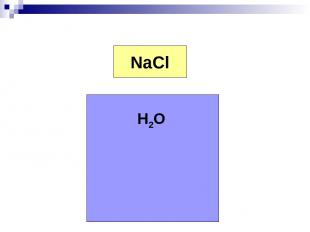
Na+ Cl- NaCl H2O
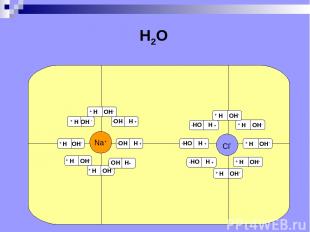
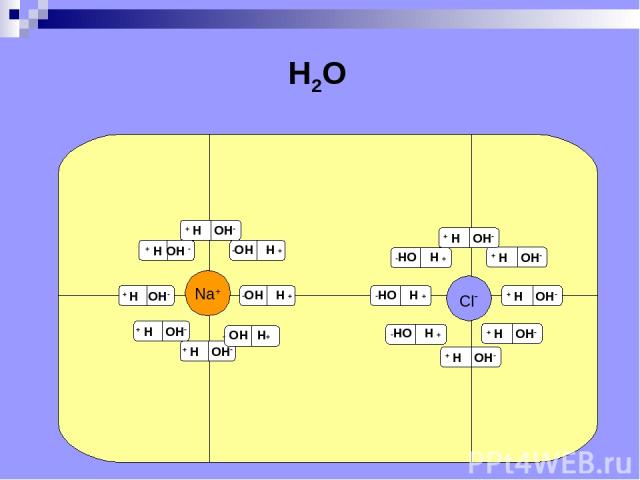
Na+ Cl- H2O
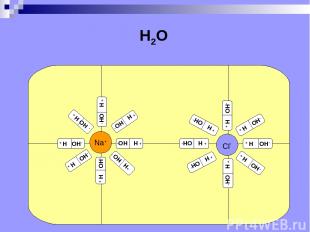
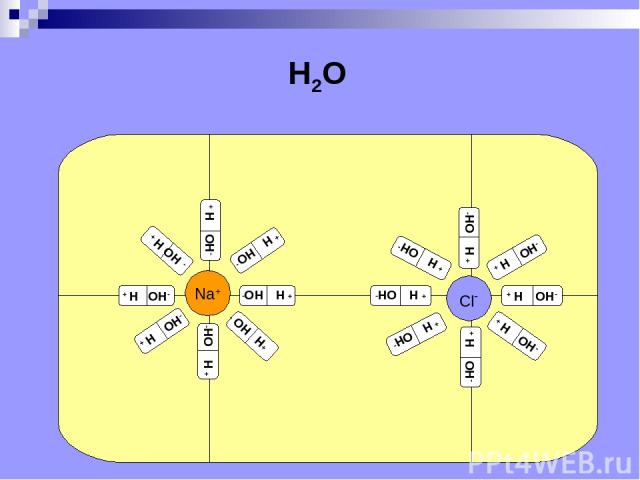
H2O

Электролитическая диссоциация расщепление молекул электролита на положительные и отрицательные ионы под действием растворителя (от лат. dissociatio - разъединение).

Степень диссоциации отношение количества молекул, диссоциировавших на ионы, к общему количеству молекул данного вещества.

Электролиз выделение на электродах веществ, входящих в состав электролита, при протекании через его раствор (или расплав) электрического тока.

Закон Фарадея: -электрохимический эквивалент вещества (1) (2) (3)

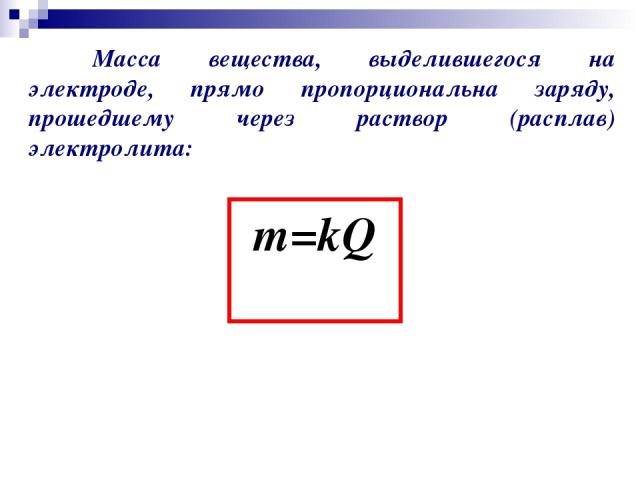
Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, прошедшему через раствор (расплав) электролита: m=kQ

Масса вещества, выделившегося на электроде, прямо пропорциональна силе тока и времени прохождения тока через раствор (расплав) электролита: m=kIt Учитывая, что Q=It, получим:

Согласно (3): (6) (6) – второй закон Фарадея (7) F- постоянная Фарадея (5) (4)

Объединенный закон Фарадея: