Презентация на тему: Электрический ток в электролитах 10 класс

физика Презентация на тему «Электрический ток в электролитах» учениц 10 В класса Русаковой Л. и Кузнецовой Н.

Электролиты ЭЛЕКТРОЛИТЫ-вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также (что встречается значительно чаще) растворы солей, кислот или оснований в полярных растворителях, например в воде.

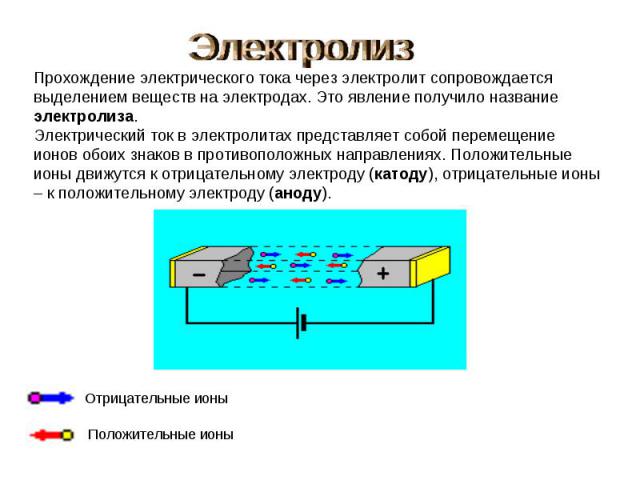
Электролиз Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза. Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду).
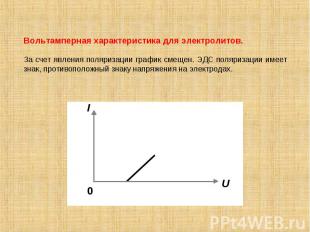
Вольтамперная характеристика для электролитов. За счет явления поляризации график смещен. ЭДС поляризации имеет знак, противоположный знаку напряжения на электродах.


Фарадей Майкл (22.IX.1791–25.VIII.1867) Английский физик и химик. Один из основателей количественной электрохимии. Установил (1833–1836) количественные законы электролиза. Законы электролиза Фарадея 1 При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку. 2 При прохождении через электролит одного и того же количества электричества масса превращенного вещества зависит от массы и заряда ионов вещества.
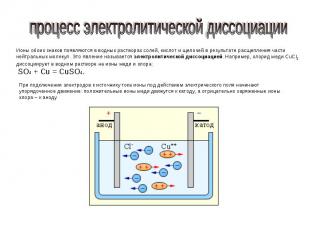
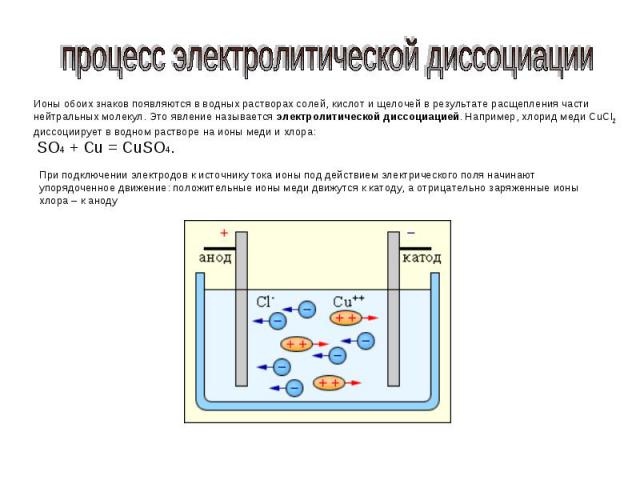
процесс электролитической диссоциации Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора: SO4 + Cu = CuSO4. При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду

электролитическая диссоциация
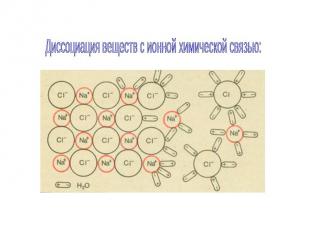
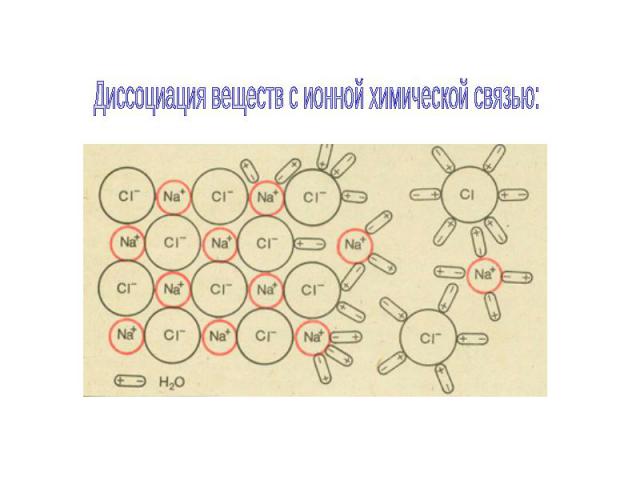
Диссоциация веществ с ионной химической связью:

Схема электролитической диссоциации на примере хлора и натрия
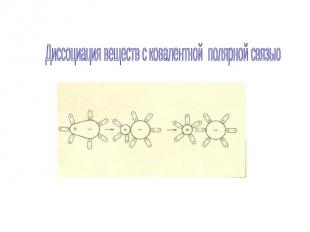
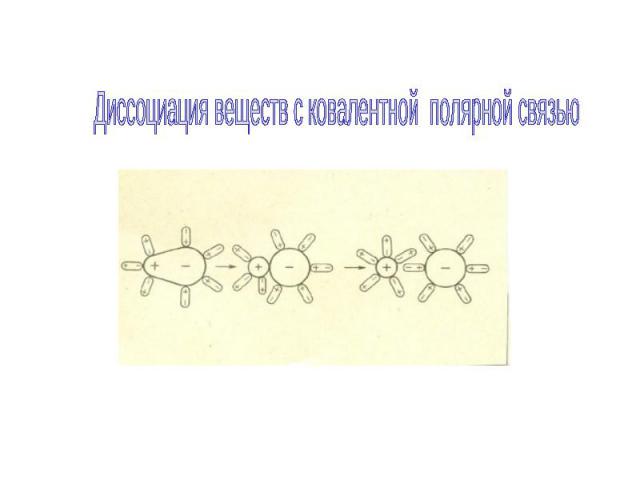
Диссоциация веществ с ковалентной полярной связью

конец