Презентация на тему: 13 1-е начало термодинамики, теплоемкость, работа

Полная энергия системы складывается из кинетической энергии системы Ек (если скорость центра масс системы как целого не равна 0) + потенциальной энергии системы во внешнем поле сил Еп + внутренней энергии U системы. Полная энергия системы складывается из кинетической энергии системы Ек (если скорость центра масс системы как целого не равна 0) + потенциальной энергии системы во внешнем поле сил Еп + внутренней энергии U системы. Термодинамика имеет дело с внутренней энергией U, которая обладает той особенностью, что в термодинамические формулы входит не величина U, а ее изменение или производная по какому-либо параметру. Поэтому внутреннюю энергию можно определять с точностью до произвольной постоянной. В реальных газах величина U включает в себя кинетическую энергию хаотического (теплового) движения молекул + взаимную потенциальную энергию, зависящую от взаимного расположения молекул (зависит от расстояния). При этом, первый вклад зависит от Т , а второй от V. Т.е. U включает потенциальную энергию взаимодействия между молекулами тела, а не их потенциальная энергия во внешнем поле сил (например, в поле сил тяжести).






Теплоемкость тела - количество теплоты, которое надо сообщить телу, чтобы повысить его температуру на 1 градус. Если сообщается ∞ малое количество теплоты δQ и в результате начальная температура на dT то c= δQ/dT. Т.е. это отношение количества теплоты поглощаемой телом при ∞ малом изменении его температуры к этому изменению Теплоемкость тела - количество теплоты, которое надо сообщить телу, чтобы повысить его температуру на 1 градус. Если сообщается ∞ малое количество теплоты δQ и в результате начальная температура на dT то c= δQ/dT. Т.е. это отношение количества теплоты поглощаемой телом при ∞ малом изменении его температуры к этому изменению На практике имеют дело с теплоемкость единицы массы вещества, называемой удельной теплоемкостью с. Теплоемкость моля вещества - молярной теплоемкостью. Далее будем говорить о ней и обозначать ее в зависимости от рассматриваемого процесса cp или cV. Она измеряется в Дж/моль К или кал/моль К (от лат. Calor–тепло, 1кал=4.1868 Дж). А на практике? Про единицы Дж/кг К и Дж/м3 К лучше не забывать (давайте посмотрим фильм про теплоемкость металлов) δQ зависит от характера процесса т.е. не только от начального и конечного состояния но и от способа которым процесса перехода был осуществлен и => от способа зависит и с. Т.е. теплоемкость различна при различных процессах и ее нельзя считать характеристикой только самого вещества.








Для жидкостей и твердых тел сp и сV близки. Для жидкостей и твердых тел сp и сV близки. В реальности полученные соотношения не позволяют вычислить зависимость всех вкладов в теплоемкость от Т (требуется знание микроструктуры вещества). Хотя опять прослеживается связь между микро и макро состояниями. Например, решеточный вклад легко охарактеризовать макропараметром – температурой Дебая. Но есть еще вклады от электронной и магнитной структуры, которые вычислить гораздо сложнее. Для реальных газов есть зависимость U(V) и => заметные отличия.





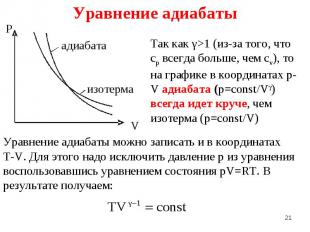



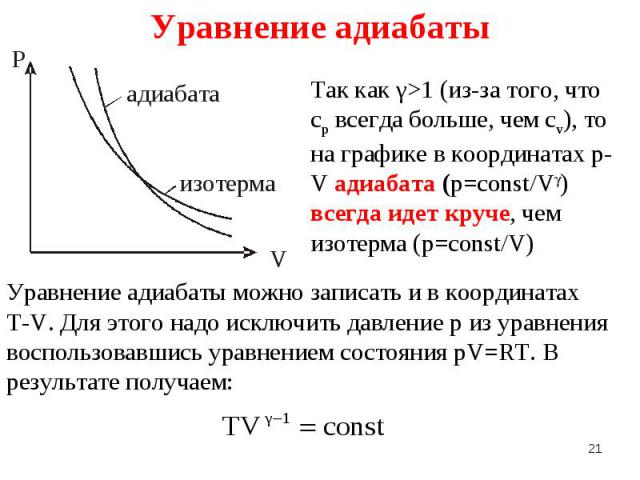
При изобарическом процессе для (p=const): При изобарическом процессе для (p=const): A=R(T2-T1) При адиабатическом процессе (δQ = 0 или S=const): При изотермическом процессе (Т=const): Т.е. замечаем , что работа всегда линейно пропорциональна величине R (надо вставить сюда для изохорического еще и всю лекцию переделать для 1 моля




Показываем пример модели машины работающей по циклу Стирлинга! Показываем пример модели машины работающей по циклу Стирлинга! Смотрим опыт Дарлинга!

Вставить хотя бы пару слайдов Вставить хотя бы пару слайдов