Презентация на тему: Обратимость химических реакций

Обратимость химических реакций Химическое равновесие.

Вопрос Какие из химических реакций являются обратимыми? 1. NaOH + HCl NaCl + H2O 2. N2 + 3H2 2NH3 3. AgNO3 + NaCl AgCl + NaNO3 4. SO3 + H2O H2SO4 5. CH4 + 2O2 CO2 + 2H2O 6. 2SO2 + O2 2SO3 7. HCOOH + CH3OH HCOOCH3 + H2O
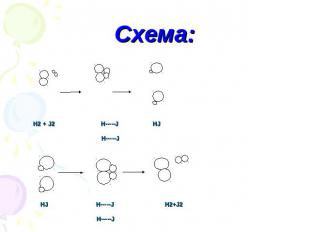
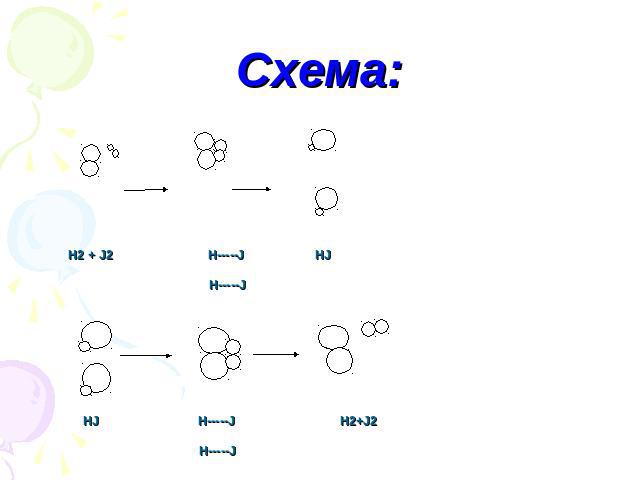
Схема:
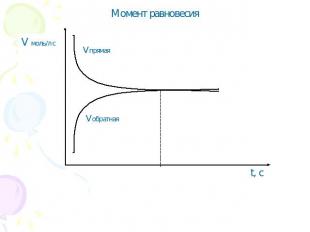
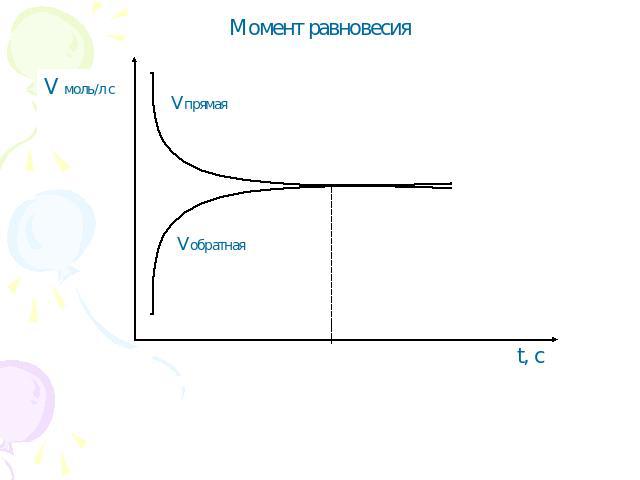
Момент равновесия
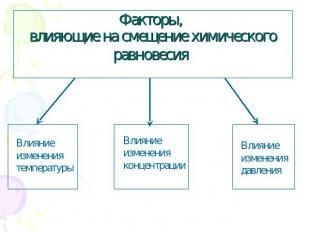
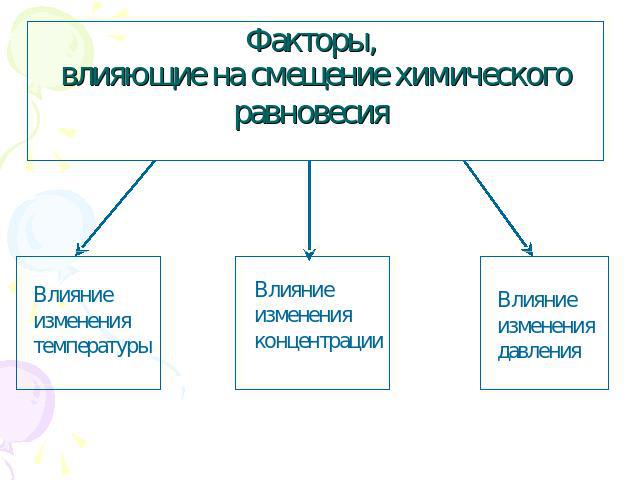
Факторы, влияющие на смещение химического равновесия
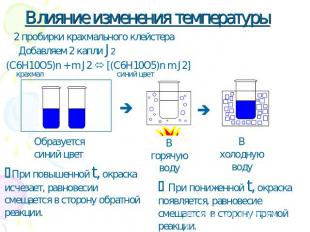
Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 (C6H10O5)n + m J2 [(C6H10O5)n m J2] Образуется синий цвет При повышенной t, окраска исчезает, равновесии смещается в сторону обратной реакции. При пониженной t, окраска появляется, равновесие смещается в сторону прямой реакции.

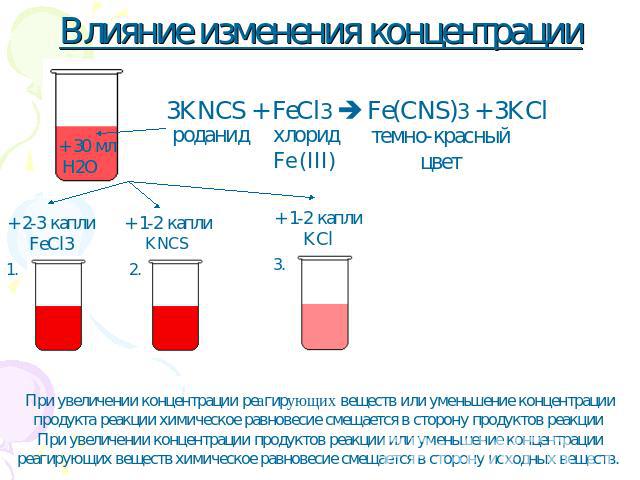
Влияние изменения концентрации При увеличении концентрации реагирующих веществ или уменьшение концентрации продукта реакции химическое равновесие смещается в сторону продуктов реакции При увеличении концентрации продуктов реакции или уменьшение концентрации реагирующих веществ химическое равновесие смещается в сторону исходных веществ.

Влияние изменения давления При увеличении давления равновесие смещается в сторону меньшего объема При сжатии цвет газа стал бледно-желтым, а равновесие сместилось в сторону прямой реакции. При расширении цвет газа стал темно-бурым, а равновесие сместилось в сторону обратной реакции.
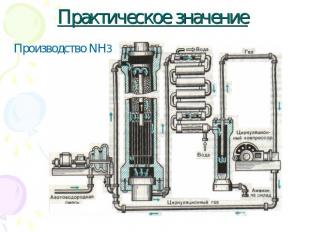
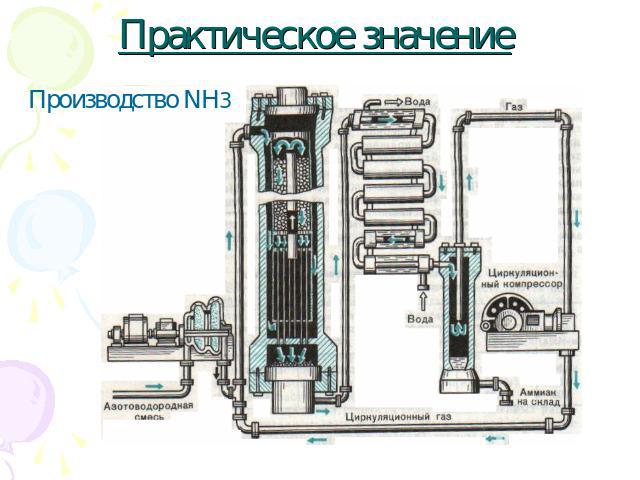
Практическое значение Производство NH3
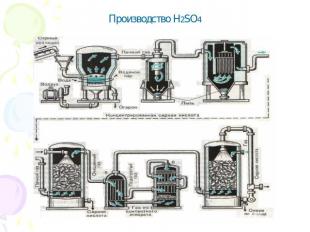
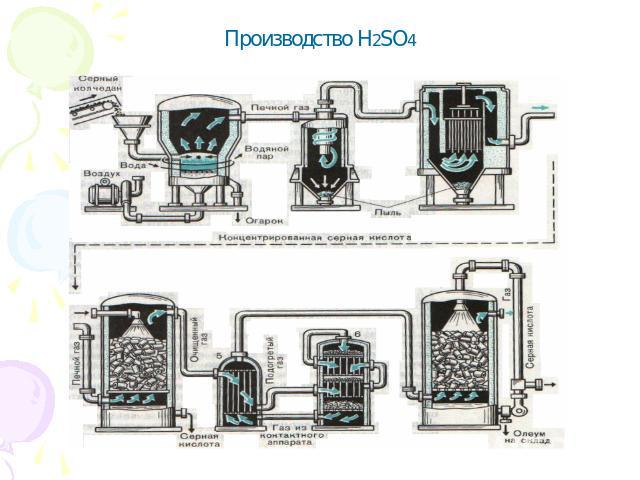
Производство H2SO4

Производство HNO3

Смещение химического равновесия Смещение химического равновесия обеспечивает высокий выход желаемого продукта.2. Открывает путь к управлению химическими реакциями.

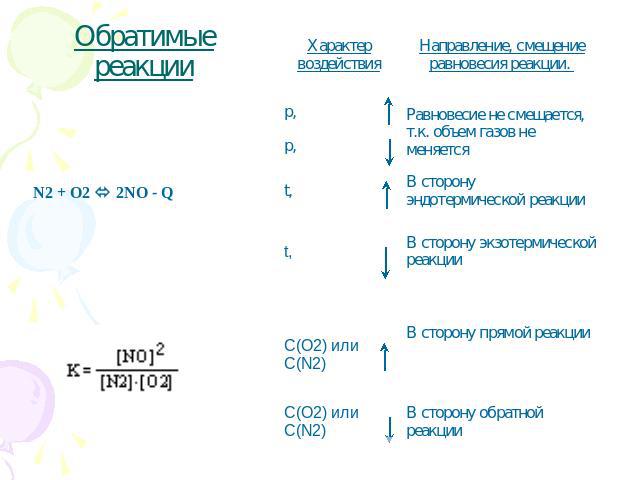
Обратимые реакции



![Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 (C6H10O5)n + m J2 [(C6H10O5)n m J2] Образуется синий цвет При повышенной t, окраска исчезает, равновесии смещается в сторону обратной реакции. При пониженной t, окр… Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 (C6H10O5)n + m J2 [(C6H10O5)n m J2] Образуется синий цвет При повышенной t, окраска исчезает, равновесии смещается в сторону обратной реакции. При пониженной t, окр…](/images/15/5198/640/img5.jpg)