Презентация на тему: Скорость химических реакций

Скорость химических реакций

Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растворах, практически мгновенно.

Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени: если объем системы не меняется. Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности: где S — площадь поверхности соприкосновения веществ (м2,см2).

Факторов влияющие на скорость химической реакции. Природа реагирующих веществ Температура Концентрация реагирующих веществ Катализатор Площадь соприкосновения веществ
Природа реагирующих веществ

Попробуй сам Налейте в две пробирки соляную и уксусную кислоты. В каждую пробирку добавьте кусочек цинка. Напишите уравнение реакции. В какой пробирке реакция протекает быстрее? Почему? Проверь себя:

Выполни эксперимент. В 2 пробирки налей те уксусной кислоты и добавьте несколько гранул цинка. Одну пробирку нагрейте. В какой из пробирок реакция идет быстрее? Как влияет температура на скорость реакции?

Температура При повышении температуры в большинстве случаев скорость химической реакции значительно увеличивается. В прошлом веке голландский химик Я. Х. Вант-Гофф сформулировал правило: Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2–4 раза (эту величину называют температурным коэффициентом реакции). При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля «активных» молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции. Математически эта зависимость выражается соотношением

Выполни В 1 пробирку налей раствор НСl. Во 2 пробирку концетр. НСl. В каждую пробирку добавь гранулы цинка. В какой пробирке реакция идет быстрее? Как влияет концентрация реагирующих веществ на скорость реакции? Почему?

Концентрация реагирующих веществ Закон действующих масс. Математически зависимость скорости от концентрации для реакции: 2А+В=АВ выражается следующим образом: Пример:
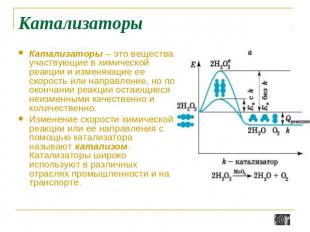
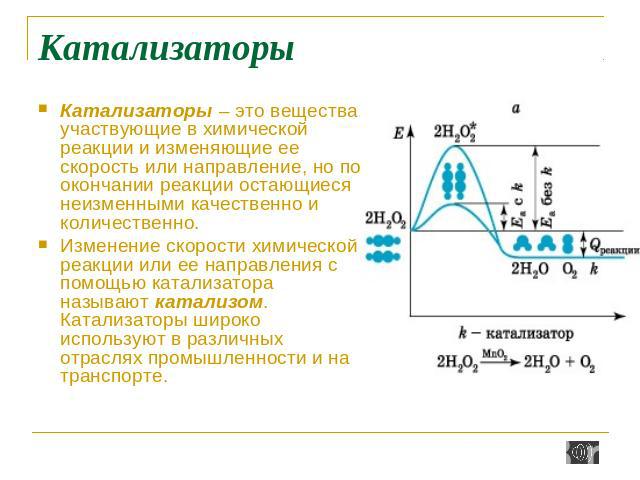
Катализаторы Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными качественно и количественно. Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте.

Попробуй сам В 2 пробирки налить по 2 мл раствора медного купороса и добавить гранулы алюминия. В одну из пробирок добавить несколько кристаллов хлорида натрия. Что наблюдаете? Запишите уравнение реакции. Проверь себя

Поверхность соприкосновения реагирующих веществ (попробуй сам). Налейте в 2 пробирки уксусной кислоты. Добавьте в 1 пробирку кусочек мела. Во 2 пробирку порошок мела. Напишите уравнение реакции. Как зависит скорость реакции от площади соприкосновения веществ? Проверь себя: