Презентация на тему: классификация электротехнических материалов



нормальное (устойчивое): электроны находятся на орбитах, ближайших к ядру (потенциальная энергия атома минимальна); нормальное (устойчивое): электроны находятся на орбитах, ближайших к ядру (потенциальная энергия атома минимальна); возбужденное: переход одного или нескольких электронов на более удаленные от ядра орбиты. ионизация атома(молекулы): образование двух независимых (свободных) частиц – электрона и положительно заряженного иона.
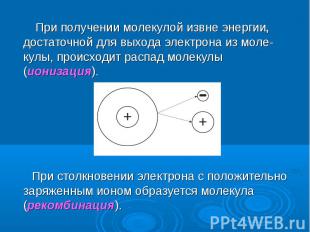
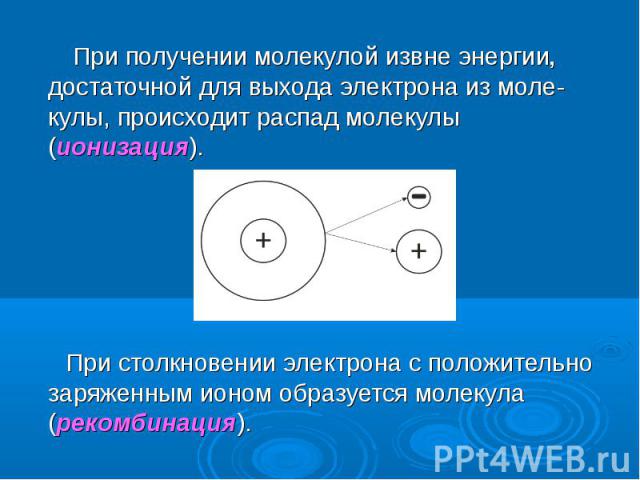
При получении молекулой извне энергии, достаточной для выхода электрона из моле-кулы, происходит распад молекулы (ионизация). При получении молекулой извне энергии, достаточной для выхода электрона из моле-кулы, происходит распад молекулы (ионизация). При столкновении электрона с положительно заряженным ионом образуется молекула (рекомбинация).

Энергия возбуждения (Wв) – разница энергий электрона на удаленной и нормальной орбитах. Время пребывания атома (молекулы) в возбужденном состоянии составляет примерно 10-10 с. Возвращение атома в нормальное состояние происходит самопроизвольно и сопровождается излучением кванта энергии – фотона. Энергия, которую необходимо сообщить атому (молекуле) для осуществления ионизации, называется энергией ионизации (Wи) Единицей измерения энергии возбуждения и ионизации является электрон – вольт (эВ).

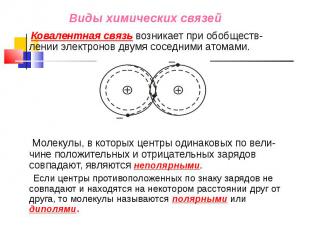
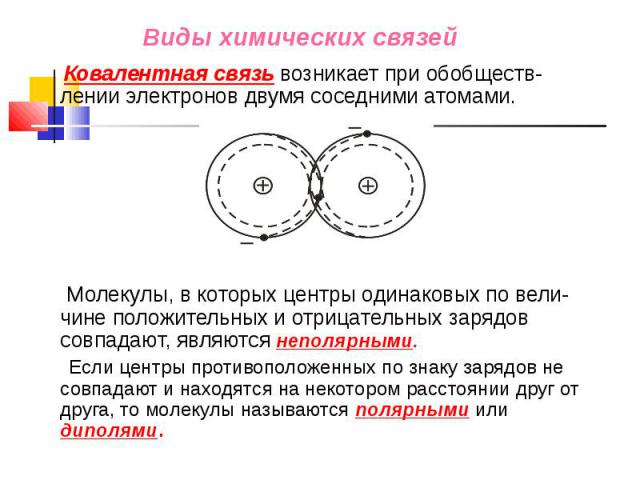
Ковалентная связь возникает при обобществ-лении электронов двумя соседними атомами. Ковалентная связь возникает при обобществ-лении электронов двумя соседними атомами. Молекулы, в которых центры одинаковых по вели-чине положительных и отрицательных зарядов совпадают, являются неполярными. Если центры противоположенных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то молекулы называются полярными или диполями.
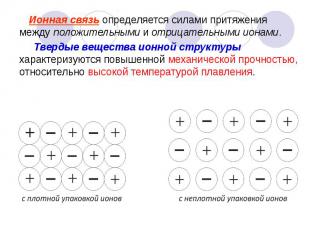
Ионная связь определяется силами притяжения между положительными и отрицательными ионами. Ионная связь определяется силами притяжения между положительными и отрицательными ионами. Твердые вещества ионной структуры характеризуются повышенной механической прочностью, относительно высокой температурой плавления.
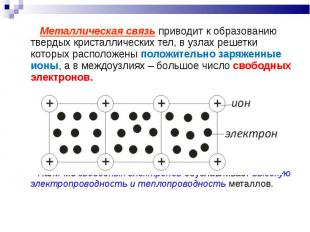
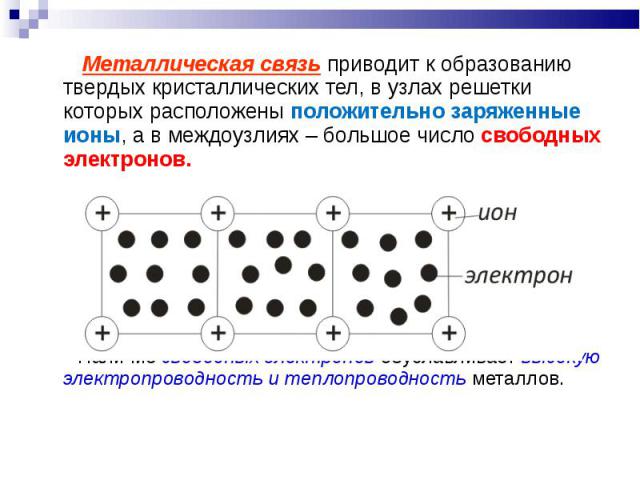
Металлическая связь приводит к образованию твердых кристаллических тел, в узлах решетки которых расположены положительно заряженные ионы, а в междоузлиях – большое число свободных электронов. Металлическая связь приводит к образованию твердых кристаллических тел, в узлах решетки которых расположены положительно заряженные ионы, а в междоузлиях – большое число свободных электронов. Наличие свободных электронов обуславливает высокую электропроводность и теплопроводность металлов.
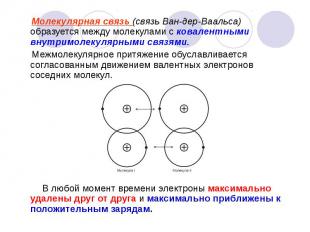
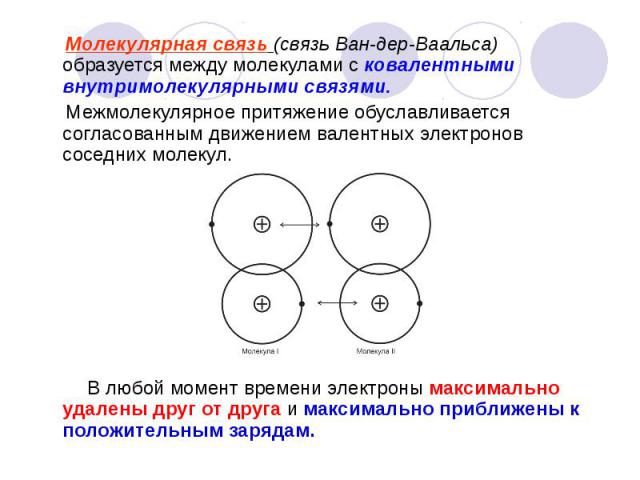
Молекулярная связь (связь Ван-дер-Ваальса) образуется между молекулами с ковалентными внутримолекулярными связями. Молекулярная связь (связь Ван-дер-Ваальса) образуется между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение обуславливается согласованным движением валентных электронов соседних молекул. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам.

Микроструктура – характер упорядоченности элементарных частиц: атомов, ионов, молекул. Микроструктура – характер упорядоченности элементарных частиц: атомов, ионов, молекул. Кристаллическая структура – упорядоченное расположение элементарных частиц. Аморфная структура - хаотичное расположение элементарных частиц. Макроструктура – характер формирования отдельных областей в материалах, которые имеют специфические свойства: - доменная структура; - пористая структура; - слоистая структура; - волокнистая структура.

По способности проводить электрический ток все материалы делятся на: проводники; полупроводники; диэлектрики.

Диэлектрики - это материалы, у которых запрещенная зона настолько велика, что электронной электропроводности в обычных условиях не наблюдается. Диэлектрики - это материалы, у которых запрещенная зона настолько велика, что электронной электропроводности в обычных условиях не наблюдается. Полупроводники - это материалы с узкой запрещенной зоной, которая может быть преодолена за счет внешних энергетических воздействий. Проводники – это материалы, у которых заполненная электронами зона вплотную прилегает к зоне свободных энергетических уровней или даже перекрывается ею.

Слабомагнитные Сильномагнитные Слабомагнитные Сильномагнитные диамагнетики парамагнетики ферромагнетики ферриты <1 >1 водород, кислород, железо, сплавы инертные газы, алюминий, никель, хрома и медь, платина, кобальт марганца цинк , щелочные и их сплавы серебро, металлы, золото. соли железа

По назначению: По назначению: изоляционные материалы: диэлектрики с ρ>1012 Ом м при t=200C; для заполнения конденсаторов: чем больше диэлектрическая проницаемость (Ɛ) , тем больше емкость конденсатора (С) при тех же самых размерах; активные диэлектрики для изготовления: миниатюрных радиоконденсаторов; варикондов (переменная емкость, зависит от величины приложенного напряжения); терморезисторов (позисторов), сопротивление которых зависит от температуры. Позисторы используются как датчики температуры.

по агрегатному состоянию: по агрегатному состоянию: газы; жидкие диэлектрики; твердые диэлектрики; твердеющие (лаки, компаунды) по химическому составу: неорганические; органические по строению (структуре): молекулярной структуры(все газы, все жидкие диэлектрики, некоторые твердые диэлектрики); неполярные: все газы, трансформаторное масло, полиэтилен, фторопласт-4 и другие; полярные: хлорированные дифенилы, целлюлоза, поливинилхлорид и другие.

ионной структуры (твердые диэлектрики): ионной структуры (твердые диэлектрики): с плотной упаковкой ионов: кварц, слюда, корунд, рутил, каменная соль и другие; с неплотной упаковкой ионов: неорганические стекла, фарфор, микалекс и другие. доменной структуры (сегнетоэлектрики): сегнетова соль, титанат бария и другие.


Сокращение названий синтетических изоляционных материалов: Сокращение названий синтетических изоляционных материалов: Эскапон (синтетический каучук Пономарева, созданный им в 1939г.) Лавсан (лаборатория высокомолекулярных соединений академии наук)