Презентация на тему: Система фармаконадзора в Украине: история становления, результаты, перспективы


Впервые молодому государству в кратчайший срок жизненно необходимым было создать институции, обеспечивающие формирование и реализацию государственной политики в области ЛС. Впервые молодому государству в кратчайший срок жизненно необходимым было создать институции, обеспечивающие формирование и реализацию государственной политики в области ЛС.

История становления фармаконадзора в Украине 1996 г. – создан Центр побочного действия ЛС Государственного фармакологического центра МЗ Украины 1999 г. – создан Отдел фармакологического надзора Государственного фармакологического центра МЗ Украины 1999 г. – создание Национальной базы данных о ПР ЛС 1999 г. – Украина стала ассоциированным членом Программы ВОЗ по мониторингу ПР ЛС 2000 г. – Приказ МЗ Украины №347 «Об утверждении инструкции об осуществлении надзора за побочными реакциями/действами лекарственных средств» (зарегистрированный в Минюсте Украины) 2001 г. – Приказ МЗ Украины №51 «Об организации представления информации о побочных действиях лекарственных средств» (утверждена карта-сообщение и порядок предоставления информации о ПР ЛС) 2001 г - Приказ МЗ Украины №292 «Об усовершенствовании организации предоставления информации о побочной реакции лекарственных средств» (утверждена форма государственной статистической отчетности лечебных учреждений о ПР ЛС и методические рекомендации для заполнения и предоставления карты-сообщения о ПР ЛС) 2001-2002 гг. – проведение семинаров во всех регионах Украины, г. Киеве и Севастополе по вопросам осуществления фармаконадзора

История становления фармаконадзора в Украине 2002 г. – создание 10-ти региональных отделений по фармаконадзору 2002 г. – Украина стала действительным членом Программы ВОЗ по мониторингу ПР ЛС 2003 г. – перевод и издание Руководства по фармаконадзору (THE RULES GOVERNING MEDICINAL PRODUCTS IN THE EUROPEAN UNION, VOLUME 9 – Pharmacovigilance Medicinal Products for Human and Veterinary use), разработанного в рамках процесса ICH и принятого в ЕС) 2003-2004 гг. – проведены28 исследований профиля безопасности ЛС 2006 г. – обновление законодательной базы по осуществлению фармаконадзора. В 2007 г. вступил в силу приказ МЗ Украины №898 (прописано законодательное поле осуществления фармаконадзора для производителей ЛС, взаимодействия между партнерами по осуществлению фармаконадзора) 2007 г. – создано и издано руководство по фармаконадзору «Безопасность лекарств» 2007 г. – проведена Первая научно-практическая конференция с международным участием «Безопасность ЛС: от разработки до медицинского применения» 2007 г. – изданы методические рекомендации «Принципы создания и порядок предоставления производителем информации о ПР ЛС» 2007 г. – семинар «Современное состояние и перспективы процедуры регистрации и перерегистрации в Украине» 2007 г. – начал издаваться журнал «Рациональная фармакотерапия»

История становления фармаконадзора в Украине 2008 г. – создано Управление послерегистрационного надзора и 27 региональных отделений по фармаконадзору как структурные единицы Государственного фармакологического центра МЗ Украины 2009 г. – переведено и издано Европейское руководство для осуществления фармаконадзора (Том 9а) как основа национального руководства по фармаконадзору 2009 г. – создан тренинговый курс по фармаконадзору для производителей ЛС 2009 г. – проведена Вторая научно-практическая конференция с международным участием «Безопасность ЛС: от разработки до медицинского применения» 2009 г. – издано пособие по безопасности применения кардиотропных ЛС 2009-2010 гг. – реализован пилотный проект по мониторингу эффективности и безопасности ЛС в стационарах лечебных учреждений Житомирского региона 2011 г. – создана типичная презентация по фармаконадзору для врачей 2011 г. – создан тренинговый курс «Фармаконадзор: контроль ПР и эффективности антиретровирусных ЛС при лечении пациентов с ВИЧ-инфекциями» 2011 г.- создан лекционный курс и тестовые задания элективного курса «Побочные действия ЛС» для студентов медицинских ВУЗов 2011 г. – создано пособие по безопасности применения НПВЛС 2011 г. – создана страница на сайте Государственного экспертного центра, на которой размещается информация об изменениях в инструкциях по медицинскому применению, связанная с безопасностью ЛС (http://www.pharma-center.kiev.ua/view/farmn)

Директива 2001/83/ЕС от 06.11.2001 «О своде законов Сообщества в отношении лекарственных препаратов для человека» Директива 2001/83/ЕС от 06.11.2001 «О своде законов Сообщества в отношении лекарственных препаратов для человека» Постановление Совета ЕС от 22.07.93 №2309/93 по вопросам фармаконадзора «Фармаконадзор. Правила ЕС в отношении фармаконадзора за лекарственными препаратами для человека и для применения в ветеринарии» (THE RULES GOVERNING MEDICINAL PRODUCTS IN THE EUROPEAN UNION, VOLUME 9 – Pharmacovigilance Medicinal Products for Human and Veterinary use), разработанного в рамках процесса ICH и принятого в ЕС)

Закон Украины «О лекарственных средствах» 1996 г., с изменениями и дополнениями 1998 г. Закон Украины «О лекарственных средствах» 1996 г., с изменениями и дополнениями 1998 г. Приказы МЗ Украины: 27.12.2006 г. № 898 «Об утверждении Порядка осуществления надзора за побочными реакциями ЛС, разрешенных к медицинскому применению в Украине» (гармонизирован с директивами ЕС) 24.07.2009 г. № 531 «Об утверждении Порядка осуществления мониторинга безопасности и эффективности ЛС в стационарах учреждений здравоохранения” 01.09.2009 г. №654 «Об утверждении Плана мероприятий по улучшению осуществления послерегистрационного надзора за безопасностью и эффективностью ЛС в стационарах учреждений здравоохранения» 31.08.2010 г. № 736 “О мероприятиях по внедрению мониторинга безопасности и эффективности ЛС в стационарах учреждений здравоохранения”

Мальцев Владимир Иванович (1948-2008)

Викторов Алексей Павлович (1945-2011)

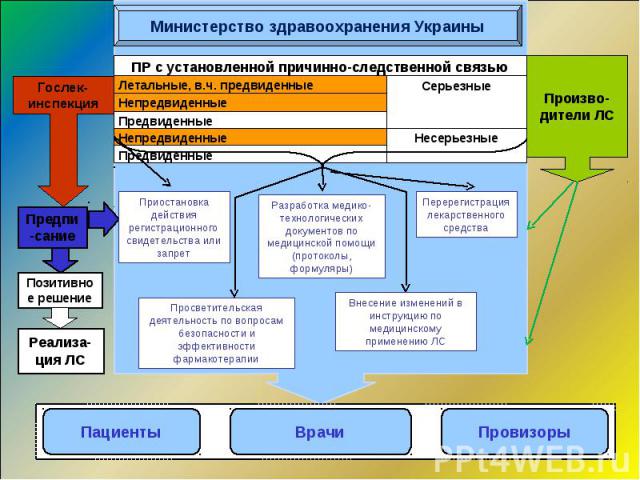
п. 1.3. Осуществление надзора за побочными реакциями лекарственных средств, разрешенных к медицинскому применению, возложено МЗ Украины на ГП «Государственный экспертный центр МЗ Украины». п. 1.3. Осуществление надзора за побочными реакциями лекарственных средств, разрешенных к медицинскому применению, возложено МЗ Украины на ГП «Государственный экспертный центр МЗ Украины». (Приказ МЗ Украины от 27.12.2006г. №898 п.1.3)

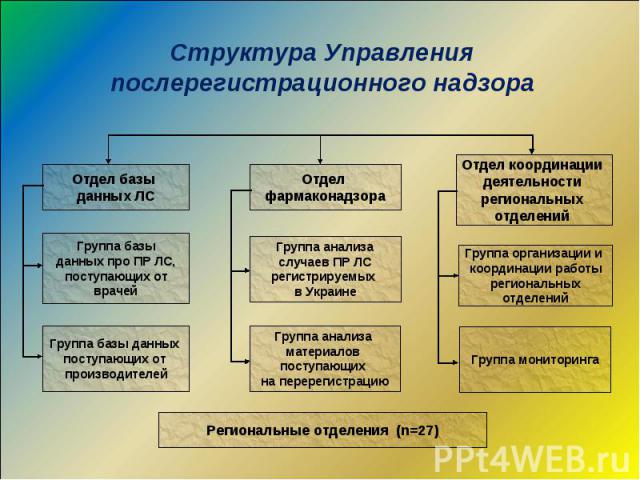
Действующая система фармаконадзора в Украине Приказ МЗ № 898 от 27.12.06 г.

Примеры подходов к осуществлению регулирования оборота ЛС в разных странах мира
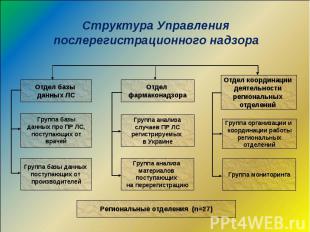


Основные направления работы системы фармаконадзора в Украине Информационное и методическое обеспечение системы здравоохранения по вопросам безопасности ЛС (в том числе, разработка и проведение специализированных и общих тренинговых программ, курсов. За последние 2 года в тренингах приняло участие 28 459 чел.) Осуществление сбора, анализа и обобщения информации о безопасности и эффективности применения ЛС, полученной от врачей, производителей, международных организаций Осуществление контроля за функционированием ФН в системе здравоохранения и производства ЛС Подготовка предложений для МЗ о полном или частичном запрещении медицинского применения ЛС, внесении дополнений или изменений в инструкцию по медицинскому применению ЛС Проведение специализированной экспертной оценки перерегистрационных материалов по безопасности ЛС
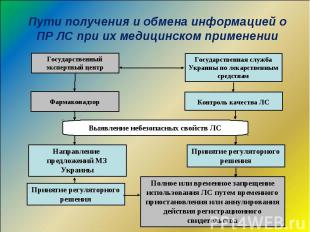

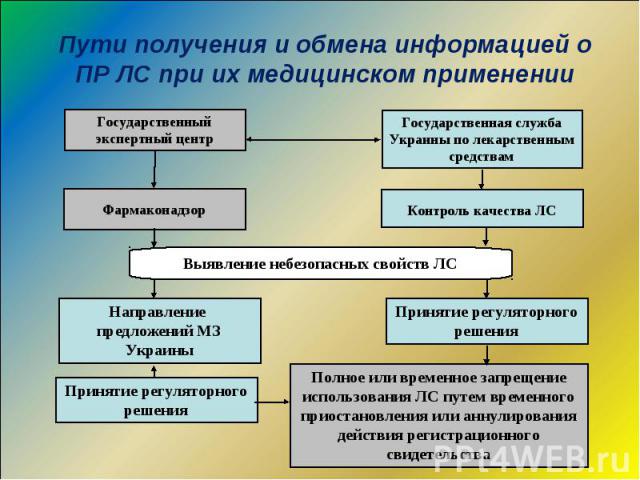
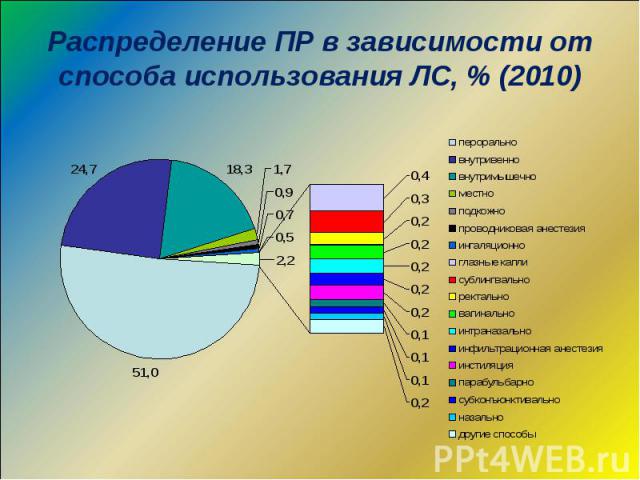
Спонтанные сообщения о подозреваемых ПР ЛС Спонтанные сообщения о подозреваемых ПР ЛС Фармакоэпидемиологические исследования Мониторинг ПР ЛС
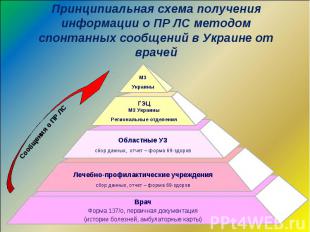





Усиление регионального, в частности, административного регулирования осуществления фармаконадзора Четкое планирование и активизация работы РО Включение в состав РО главных специалистов по специальности “Терапия” МЗ АР Крым, областных УЗ и городских УЗ г. Киева и Севастополя Утверждение Плана мероприятий по улучшению осуществления надзора за безопасностью и эффективностью ЛС и мониторингу безопасности и эффективности ЛС в стационарах учреждений здравоохранения приказом МЗ Украины от 01.09.2009 р. №654

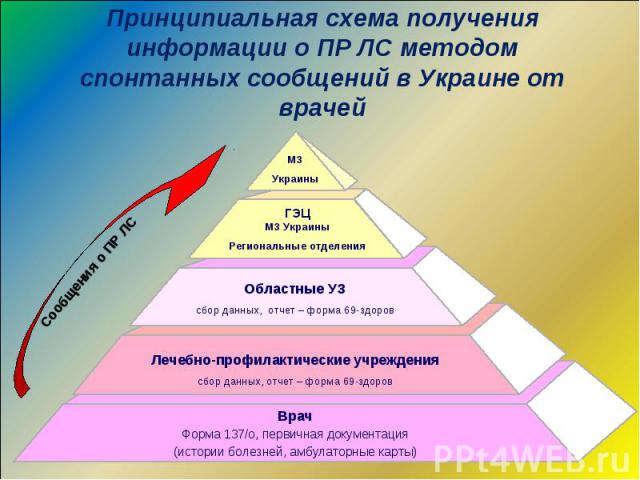
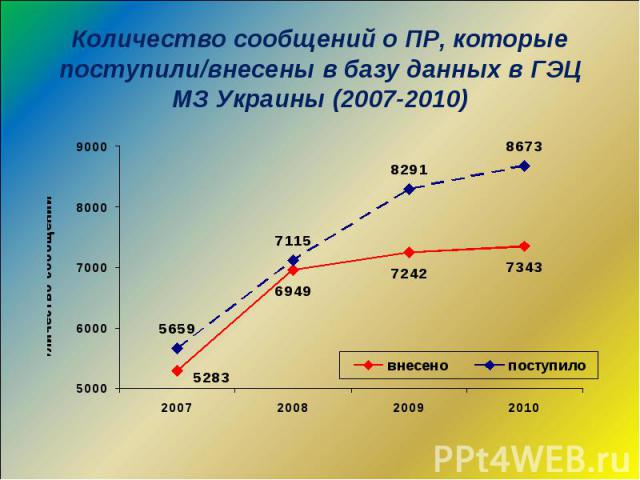
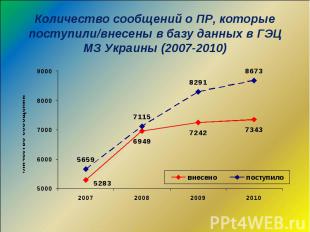
По состоянию на сегодня 27% учреждений здравоохранения принимают участие в осуществлении ФН, путем подачи сообщений О ПР ЛС По состоянию на сегодня 27% учреждений здравоохранения принимают участие в осуществлении ФН, путем подачи сообщений О ПР ЛС Все учреждения здравоохранения ежегодно подают форму государственной отчетности “69-здоров” о зафиксированных у них случаях ПР ЛС База данных ГЭЦ МЗ Украины содержит более 46 тыс. сообщений о ПР ЛС

База данных содержит 46 636 сообщений о ПР ЛС База данных содержит 46 636 сообщений о ПР ЛС Программное обеспечение базы данных позволяет оперативно получать следующие данные о: - ПР фармакологических групп ЛС; - ПР отдельных ЛС и производителей; - предвиденности ПР; - серьезности ПР; - системных, симптомных проявлениях ПР; - ПР в демографических группах; - ПР, зависящих от гендерных особенностей; - ПР при различных заболеваниях; - последствиях ПР - категории ПР - причинно-следственной связи - средствах коррекции ПР и т.д.

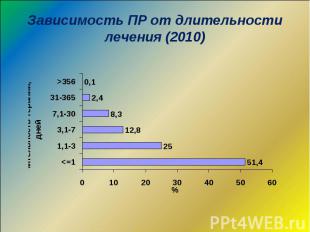
Используемые критерии оценки безопасности ЛС Частота ПР Соотношение количества непредвиденных к предвиденным ПР, серьезных к несерьезным ПР Распространенность ПР среди случаев заболеваний Формирование и подтверждение сигнала Соотношение польза/риск

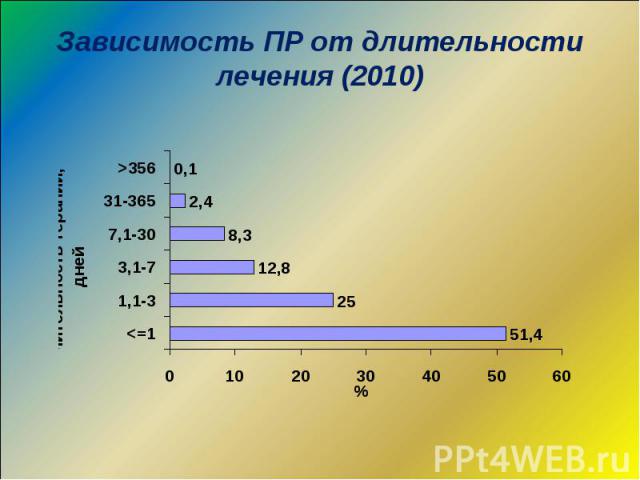
Частота ПР Свыше 10% - очень частые, требующие обязательного проведения профиля безопасности ЛС или немедленного принятие соответствующих регуляторных решений 1-10% - частые, требующие или проведения изучения профиля безопасности ЛС, или предоставления планов управления рисками, или внесения ограничений/предостережений в инструкцию для медицинского применения 0,1-1% - нечастые 0,01-0,1% - редкие менее 0,01% - редчайшие
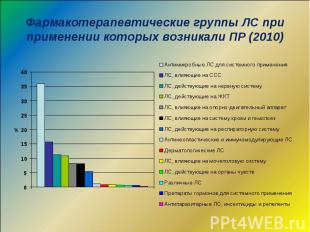
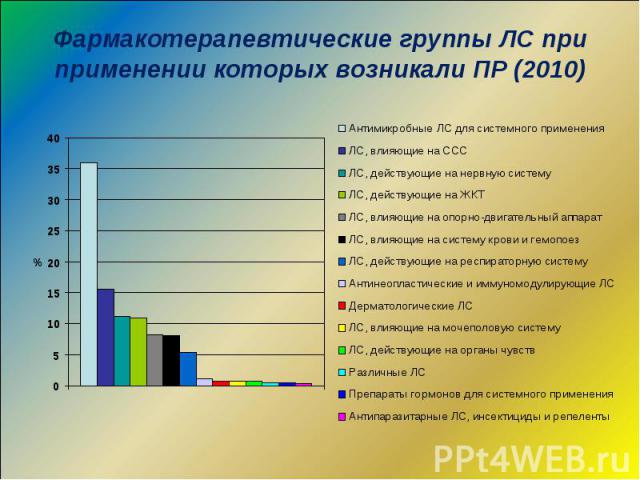
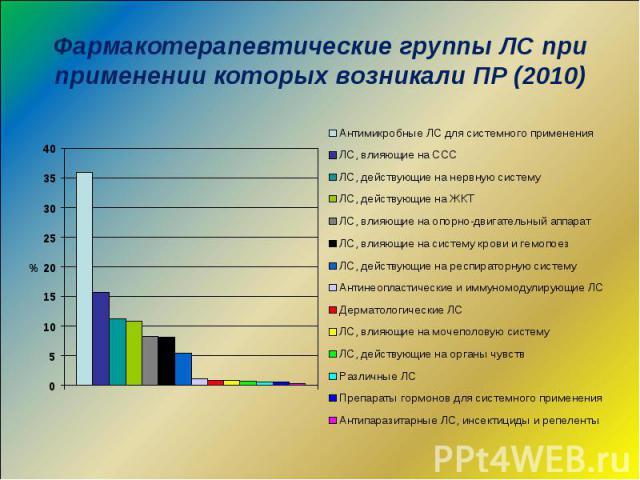
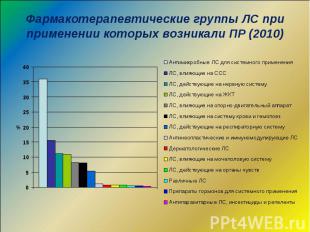
Фармакотерапевтические группы ЛС при применении которых возникали ПР (2010)
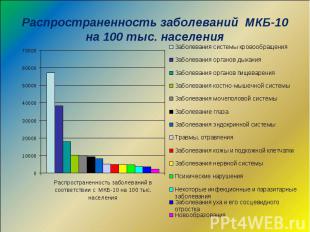
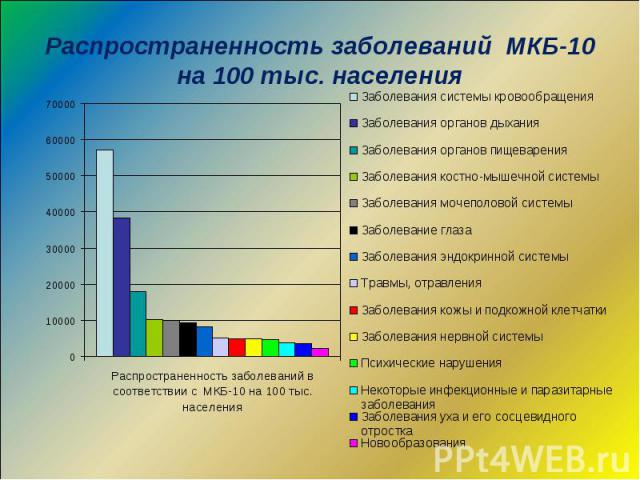
Распространенность заболеваний МКБ-10 на 100 тыс. населения
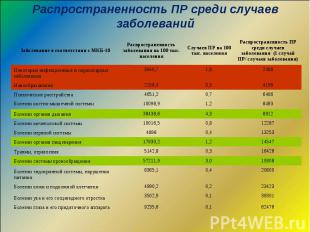
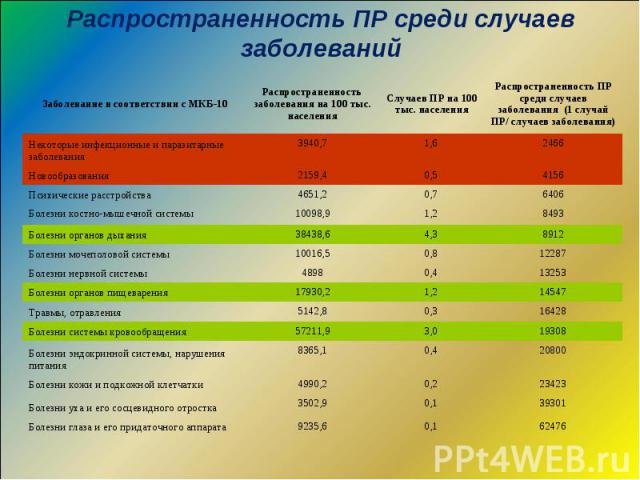
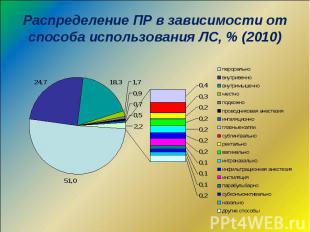
Распространенность ПР среди случаев заболеваний

Медицинские ошибки были выявлены у 2,7% карт-сообщений, полученных в 2010 г. Из них в 10% случаев именно медицинская ошибка явилась причиной возникновения ПР. По состоянию на 01.06.2011 в базе данных содержится 710 сообщений, в которых выявлены медицинские ошибки

Последовательность шагов при оценке соотношения польза/риск Анализ имеющейся достоверной информации о неблагоприятных последствиях применения ЛС Формирование и подтверждение сигнала Оценка альтернативы Принятие регуляторного решения Эуфиллин со стабилизатором этилендиамином Низкомолекулярные поливинилпиралидоны Комбинированные ЛС, содержащие нимесулид и парацетамол, резорбтивного действия Римонабант Эфализумаб Сибутрамин Розиглитазон

Тесное сотрудничество с представителями/производителями ЛС по вопросам осуществления фармаконадзора Проведение учебных семинаров и тренингов (в течение 2007-2010 г. проведено 3 семинара, 12 тренингов); Проведение индивидуальных консультаций (ежегодно более 500); Издание методических рекомендаций (“Принципы создания и порядок подачи производителем информации о ПР ЛС”) и постоянная публикация материалов по специальным вопросам фармаконадзора Совместная работа по разработке нормативной базы, методических рекомендаций и публикаций Публикация аналитических и обобщающих материалов в 23 периодических изданиях Выпуск специализированного журнала по вопросам фармаконадзора «Рациональная фармакотерапия»

Во всех компаниях назначены ответственные за осуществление фармаконадзора Во всех компаниях назначены ответственные за осуществление фармаконадзора Регулярно проводятся тренинги персонала компаний по вопросам фармаконадзора Все представители/производители ЛС подают PSUR в составе перерегистрационных материалов 47 компаний регулярно подают CIOMS- сообщения
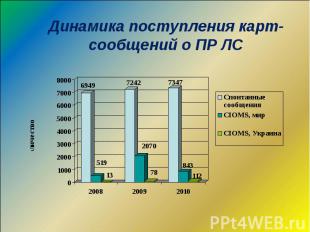
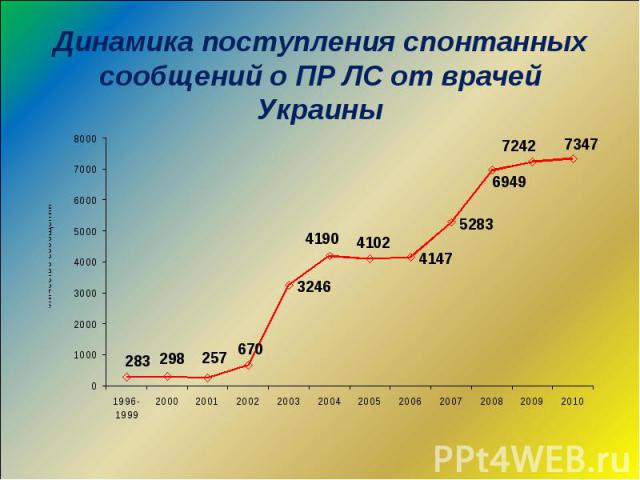
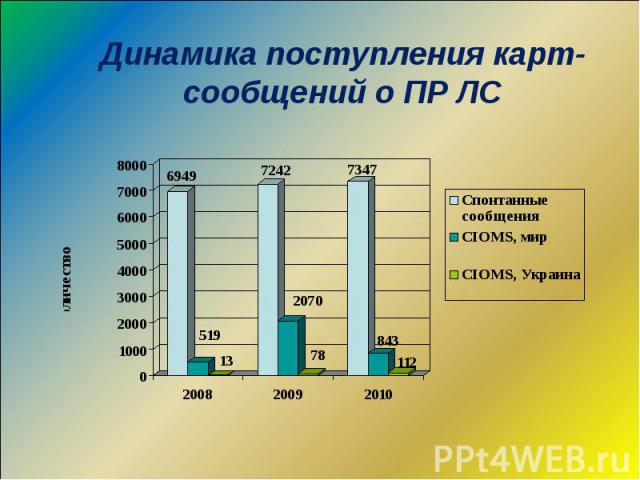
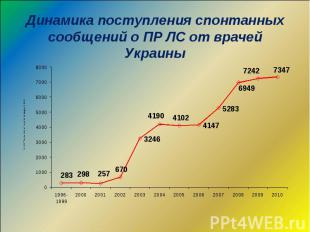
Динамика поступления карт-сообщений о ПР ЛС

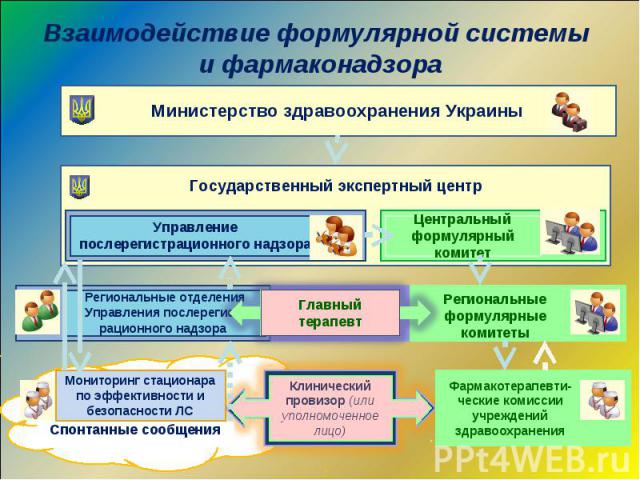
Расширение полномочий структурных подразделений системы фармаконадзора Проведение экспертизы перерегистрационных материалов по вопросам безопасности Проведение мероприятий по внедрению формулярной системы в Украине. Включение областных терапевтов (сотрудников РВ) в состав региональных формулярных комитетов

Причины, по которым вносятся изменения и дополнения в информацию по безопасности ЛС при проведении экспертизы перерегистрационных материалов І. Обобщенное представление информации в инструкции по медицинскому применению (представлены синдромы, если существует информация об их симптоматических проявлениях) ІІ. Выявление непредвиденных ПР через формирование и подтверждение сигнала ІІІ. Несоответствие данных, представленных в сообщениях информации по безопасности инструкции по медицинскому применению ІV. Несоответствие данных по безопасности в PSURе современной информации по безопасности, или той, которая отражена в инструкции по медицинскому применению

В течение 2010 г. в инструкции по медицинскому применению более чем 200 ЛС были внесены изменения и дополнения по результатам экспертизы перерегистрационных материалов в соответствии с существующей современной информацией по безопасности ЛС и данных, представленных в PSURах В течение 2010 г. в инструкции по медицинскому применению более чем 200 ЛС были внесены изменения и дополнения по результатам экспертизы перерегистрационных материалов в соответствии с существующей современной информацией по безопасности ЛС и данных, представленных в PSURах
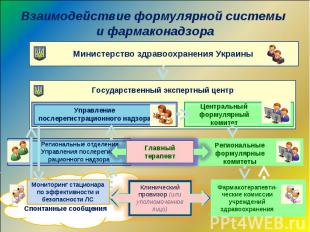

Взаимодействие формулярной системы и фармаконадзора Участие в проведении семинаров с сотрудниками РО, областными терапевтами по вопросам внедрения формулярной системы Разработка отраслевых регламентов по включению областных терапевтов в региональные формулярные комитеты

Внедрение новых методов сбора информации о ПР ЛС Реализован пилотный проект исследования “Мониторинг безопасности и эффективности ЛС (Житомирский регион)” (2009-2010 гг.) Планирование и проведение мониторинга эффективности и безопасности ЛС в стационарах УЗ в 10 регионах Украины (2010-2011 гг.) Проведение учредительных семинаров для областных терапевтов и сотрудников РО о порядке осуществления мониторинга стационаров по вопросам безопасности и эффективности ЛС

Участие в международном процессе надзора за безопасностью ЛС Ежеквартально в Центр мониторинга ВОЗ направляется не менее 30 сообщений о ПР ЛС (за последние два года направлено 249 сообщений) Сообщение о ПР мидекамицина (2003 г.) и винпоцетина (2010 г.), поступившие из Украины стали основанием генерации сигнала ВОЗ на эти ЛС Украина приняла участие в переводе на русский язык классификации ВОЗ ПР ЛС (2011 г.) и рекомендаций ВОЗ «Практическое пособие по фармаконадзору за антиретровирусными препаратами» Участие в международных конференциях, проводимых под эгидой ВОЗ

Дальнейшая гармонизация фармаконадзора в Украине в соответствии с изменениями европейского законодательства Участие в разработке статей “Государственная регистрация ЛС” и “Фармаконадзор” новой редакции Закона Украины “О лекарственных средствах” Перевод и издание тома 9А «Правила надзора за медицинскими препаратами в Европейском Союзе. Рекомендации по фармаконадзору для медицинских препаратов, предназначенных для применения у человека» (VOLUME 9A of The Rules Governing Medicinal Products in the European Union – Guidelines on Pharmacovigilance for Medicinal Products for Human Use) (2010 г.), как основы государственного руководства по фармаконадзору Внесение изменений и дополнений в приказ МЗ Украины от 27.12.2006 г. №898 “” относительно: Подключения медсестер, фармацевтов, провизоров, потребителей ЛС (или их представителей) к процессу репортирования о ПР ЛС Системы фармаконадзора и управления рисками у производителей ЛС Четкого взаимодействия партнеров процесса осуществления фармаконадзора
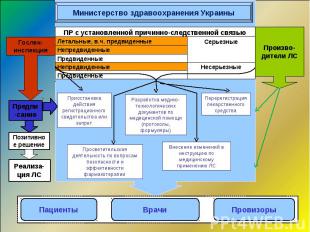

Реальный вклад системы фармаконадзора Украины в процесс безопасного применения ЛС (2009-2011) Путем формирования сигнала были внесены изменения в информацию по безопасности препаратов, действующим веществом которых является: тиотриазолин кверцетин L-лизина эсцинат натрия хлорид декстран (раствор глюкозы, реополиглюкин) раствор Рингера, Рингера лактата тивортин афлубин В 2010 г. внесены изменения и дополнения в инструкции для медицинского применения ряда инфузионных растворов и кровезаменитей в соответствии с современными данными по безопасности ЛС и экспертизы перерегистрационных материалов (созданы типовые инструкции)

Реальный вклад системы фармаконадзора Украины в процесс безопасного применения ЛС (2010) По результатам послерегистрационного надзора в инструкции по медицинскому применению ЛС более 200 ЛС были внесены изменения и дополнения. Из-за достаточного количества информации и установленной причинно-следственной связи между ПР и применением Глутаргина (ФК “Здоровье”) и Эреспала (Сервье) в раздел “Побочные реакции” инструкций по медицинскому применению были внесены изменения и дополнения: Глутаргин: изредка могут наблюдаться боль в эпигастрии, тошнота, непосредственно после применения препарата, которые проходят самостоятельно. В единичных случаях возможны аллергические реакции (крапивница, гиперемия, зуд) Эреспал – изменения внесены не только в Украине, но и во всех странах, где маркетируется это ЛС: нарушения ССС: редко – умеренная синусовая тахикардия, уменьшающаяся при снижении дозы нарушения ЖКТ: часто - расстройства пищеварения, тошнота, боль в желудке; частота неизвестна – диарея, рвота нарушения нервной системы – редко - сонливость; частота неизвестна – головокружение нарушения со стороны кожи и подкожной клетчатки: редко – эритема, фиксированная пигментная эритема, высыпания, крапивница, отек Квинке; частота неизвестна – зуд общие расстройства: частота неизвестна – астения (слабость), усталость



Возможности и задания системы фармаконадзора в Украине Прогнозирование безопасности применения ЛС в зависимости от частоты применения и использования ЛС Выявление опасных ЛС или их свойств Выявление групп риска при назначении фармакотерапии Выявление типичных медицинских ошибок как причин возникновения ПР и разработка мероприятий по их минимизации Проведение просветительной работы среди медицинских работников, потребителей ЛС (их представителей) относительно вопросов безопасности применения ЛС Внедрение мониторинга стационаров как оптимального метода сбора информации о ПР ЛС Подключение медсестер, фармацевтов, провизоров, потребителей ЛС (их представителей) к процессу репортирования о ПР ЛС Дальнейшая гармонизация законодательной базы по осуществлению фармаконадзора (внесение требований к заявителям/производителям о необходимости наличия системы фармаконадзора и системы управления рисками)