Презентация на тему: Лекарственные средства

В.К. Лепахин Руководитель Федерального центра мониторинга безопасности лекарственных средств Росздравнадзора Безопасность больных и фармаконадзор 900igr.net

Риск возникновения несчастного случая в результате лечения составляет 1 на 300 Управление безопасностью пациентов, 8-й форум по вопросам будущего ЕРБ ВОЗ, 2005 Вероятность несчастного случая вследствие авиакатастроф составляет 1 на 3 000 000

В 2000 году каждый десятый пациент европейских больниц пострадал от нежелательных эффектов лечения Рабочая группа по качеству медицинской помощи «Больницы Европы»

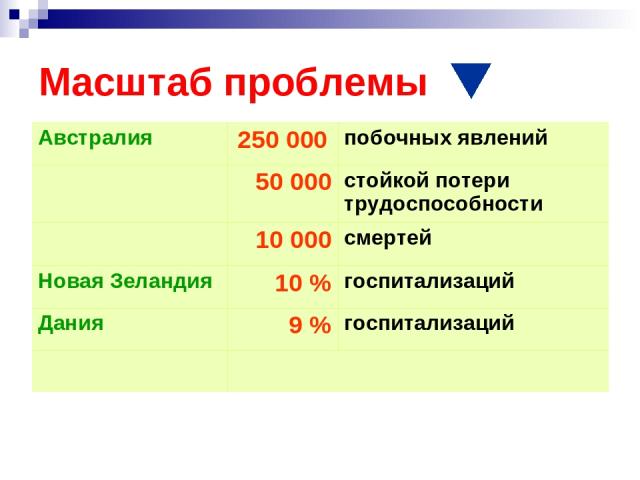
Масштаб проблемы Австралия 250 000 побочных явлений 50 000 стойкой потери трудоспособности 10 000 смертей Новая Зеландия 10 % госпитализаций Дания 9 % госпитализаций

Национальная служба здравоохранения Великобритании провела более 30 расследований в связи с катастрофическими последствиями оказания медицинской помощи. Во всех случаях были выявлены системные недостатки в организации медицинской помощи Brit. Med. J., 2002, 325: 895

Публикация Института медицины США «Ошибаться - в природе человека: построение более безопасной системы здравоохранения» сделала проблему безопасности больных предметом политического обсуждения и публичных дискуссий во всём мире. Kohn L.T. et al., To err is human: Building a safer health system. 1999, Institute of Medicine, National Academy Press

55-я сессия Всемирной ассамблеи здравоохранения (2002 г.) приняла резолюцию, обязывающую страны уделять пристальное внимание вопросам безопасности пациентов и укреплять системы безопасности и мониторинга

Неблагоприятные побочные явления (НПЯ) на лекарства и их сочетания Медицинские ошибки Некачественная, фальсифицированная и бракованная продукция Риск, связанный с использованием медицинской техники Скрытые недостатки системы здравоохранения, включая ее организацию Факторы, влияющие на безопасность больных

Если принять во внимание все типы медицинских ошибок (МО), то в условиях стационара на каждого больного может приходиться более одной МО каждый день Institute of Medicine of the National Academies USA, 2006

Медицина является историей человеческих ошибок … Немецкий микробиолог Мух

Людям свойственно ошибаться. Однако утаивать ошибки или не учиться на них – непростительно!

Министерство здравоохранения Великобритании в докладе 2000 года, озаглавленном «Организация, обладающая памятью», приводит данные, в соответствие с которыми: нежелательные реакции в результате лекарственной терапии возникают примерно у 10% стационарных больных, общее число НПР достигает 850 000 случаев в год. Dept. of Health. Report of an expert group on learning from adverse events in the NHS, 2000

Статистика НПР Ежегодно четверть миллиона жителей Великобритании поступает в стационары с неблагоприятными побочными реакциями (НПР) на лекарства Финансовые издержки, связанные с НПР, составляют приблизительно 0,5 млрд. фунтов стерлингов Около 2% больных, поступивших в стационар с НПР, умирают Reuters Health Information, May 11, 2006

Финансовые затраты, связанные с НПР на лекарства Дополнительные дни пребывания в стационаре в Великобритании обходятся приблизительно в 2000 млн. фунтов стерлингов ежегодно Выплата компенсаций по судебным искам – еще в 400 млн. фунтов стерлингов в год В США общенациональные издержки, связанные с НПР, включая выплаты по инвалидности и медицинские расходы, по разным оценкам, составляют 70 000-140 000 млн. долларов в год

Гарвардское исследование показало, что у 4% стационарных больных возникают различного рода лекарственные осложнения; в 14% случаев эти осложнения заканчиваются летальным исходом. Harvard Medical Practice Study, 1991

Типичное заблуждение как медицинских работников, так и населения «Разрешенные к применению в широкой медицинской практике лекарственные средства хорошо изучены, что гарантирует их эффективность и безопасность»

Факторы, лимитирующие возможности клинических испытаний Ограниченное число больных Селективная группа больных (жёсткие критерии включения в клинические испытания). Как правило, исключаются дети, пожилые больные, беременные, больные с сопутствующими заболеваниями и т.д. Ограничение применения других лекарственных средств Селективные дозы препаратов Ограниченный срок применения препаратов

В США с 1975 по 1999 г. было изъято с рынка 10,2 % из 548 новых химических соединений. В Испании с 1990 года по 1999 были изъяты с рынка 22 лекарственных средства. Во Франции с 1998 по 2004 годы запретили применение 21 препарата. Lasser K.E. et al. JAMA 2002, 287,2215 Arnaiz J.A., Carne X, Riba N. et al. Eur. J. clin. Pharmacol. 2001,57.89-91 Olivier P. and Montastruc J.L. Pharmacoepidemiology and drug safety 2006,15,808-812 XIV Конгресс «Человек и лекарство», 2007

В США в 50% случаев препараты были изъяты из употребления из-за неблагоприятных побочных реакций (НПР) в среднем через 2 года после начала их применения. Во Франции препараты изымались после их внедрения в медицинскую практику в среднем через 4-5 лет. Lasser K.E. et al. JAMA 2002, 287,2215 Olivier P. and Montastruc J.L. Pharmacoepidemiology and drug safety 2006,15,808-812 XIV Конгресс «Человек и лекарство», 2007

Согласно определению ВОЗ Фармаконадзор – это наука и деятельность, направленная на выявление, оценку, понимание и предупреждение неблагоприятных побочных эффектов и/или любых других возможных проблем, связанных с лекарственными средствами» В настоящее время фармаконадзор включает мониторинг безопасности лекарственных трав, биологически активных добавок и вакцин.

В Российской Федерации государственную функцию по организации проведения экспертизы качества, эффективности и безопасности ЛС выполняет Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор)

26 октября 2007 г. Росздравнадзор создал Федеральный Центр мониторинга безопасности ЛС (ФЦМБЛС) на базе ФГУ «Научный центр экспертизы средств медицинского применения»

29 января 2008 года Росздравнадзор направил письмо руководителям здравоохранения всех субъектов РФ со следующими рекомендациями : Организовать в субъектах РФ региональные центры мониторинга безопасности лекарств, определив ответственные учреждения и\или подразделения по проблемам изучения НПР на ЛС Привлечь к организации работы по выявлению и регистрации НПР главных специалистов, центры и кафедры клинической фармакологии ВУЗов, а также клинических фармакологов ЛПУ Обеспечить контроль за своевременным представлением информации о НПР в региональные и федеральный центры МБЛС
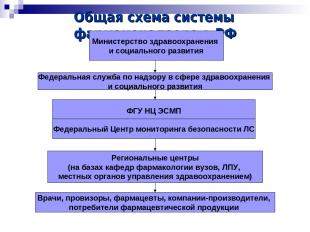
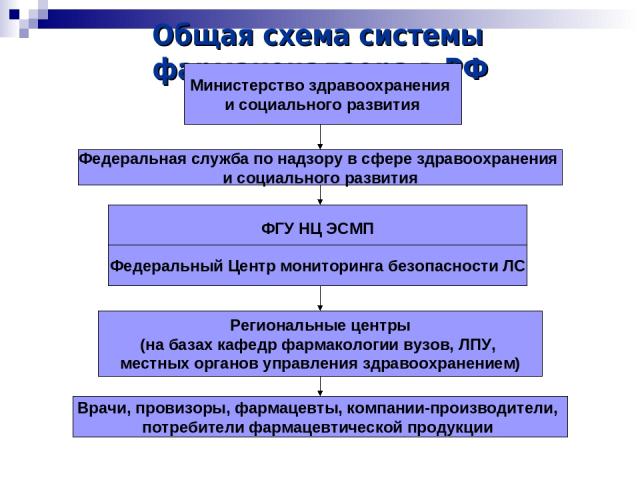
Общая схема системы фармаконадзора в РФ Министерство здравоохранения и социального развития ФГУ НЦ ЭСМП Федеральный Центр мониторинга безопасности ЛС Региональные центры (на базах кафедр фармакологии вузов, ЛПУ, местных органов управления здравоохранением) Врачи, провизоры, фармацевты, компании-производители, потребители фармацевтической продукции Федеральная служба по надзору в сфере здравоохранения и социального развития

Федеральный закон «О лекарственных средствах» в РФ В пункте 1 статьи 41 Закона о лекарственных средствах указано, что «субъекты обращения лекарственных средств обязаны сообщать федеральному органу исполнительной власти в сфере здравоохранения, органам исполнительной власти субъектов Российской Федерации в сфере здравоохранения, федеральному органу контроля качества лекарственных средств и территориальным органам контроля качества лекарственных средств обо всех случаях побочных действий и об особенностях взаимодействия лекарственных средств с другими препаратами, которые не соответствуют сведениям о лекарственных средствах, содержащимся в инструкциях по их применению».

Федеральный закон «О лекарственных средствах» в РФ В пункте 2 статьи 41 Закона о лекарственных средствах отмечается, что «за несообщение или сокрытие сведений, предусмотренных пунктом 1 настоящей статьи, лица, которым они стали известны по роду их профессиональной деятельности, несут дисциплинарную, административную или уголовную ответственность в соответствии с законодательством Российской Федерации».

«Золотой стандарт» системы спонтанных сообщений 250 –300 сообщений/ 1 млн. жителей не менее 10 % врачей присылают сообщения о НПР

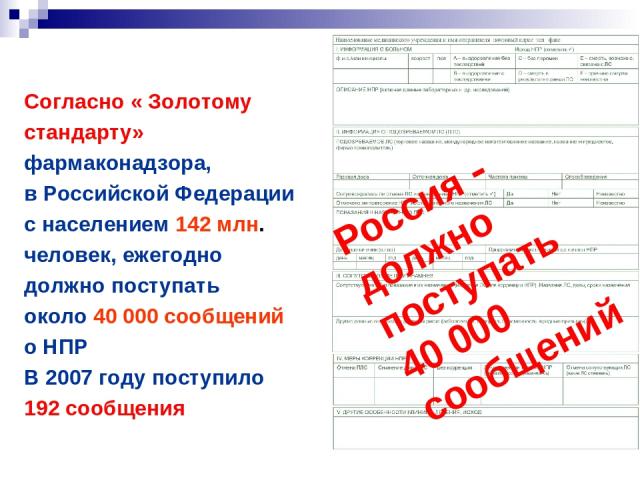
Согласно « Золотому стандарту» фармаконадзора, в Российской Федерации с населением 142 млн. человек, ежегодно должно поступать около 40 000 сообщений о НПР В 2007 году поступило 192 сообщения Россия должно поступать 40 000 сообщений

В 1997 году Россия была официально принята в Программу ВОЗ В настоящее время в этой программе участвуют более 100 стран. В базе данных ВОЗ имеется около 4 млн. сообщений о НПР В 1968 году стартовала программа ВОЗ по международному мониторингу лекарств, в которой приняли участие 10 стран

Присоединение России к Международной программе ВОЗ по мониторингу лекарств имеет большое практическое значение, так как появляется возможность своевременного получения информации из Центра ВОЗ: о побочных реакциях на лекарственные средства, о мерах профилактики и лечения лекарственных осложнений, об административных мерах по ограничению и/или запрещению применения лекарственных средств в разных странах.
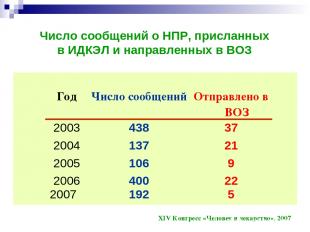
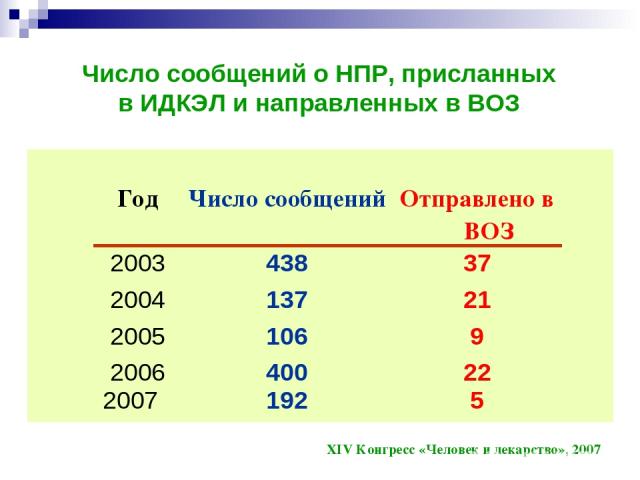
Число сообщений о НПР, присланных в ИДКЭЛ и направленных в ВОЗ XIV Конгресс «Человек и лекарство», 2007 Год Число сообщений Отправлено в ВОЗ 2003 438 37 2004 137 21 2005 106 9 2006 2007 400 192 22 5
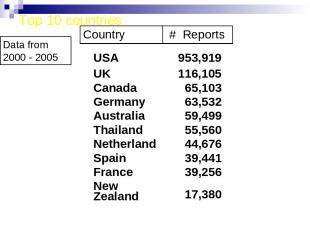
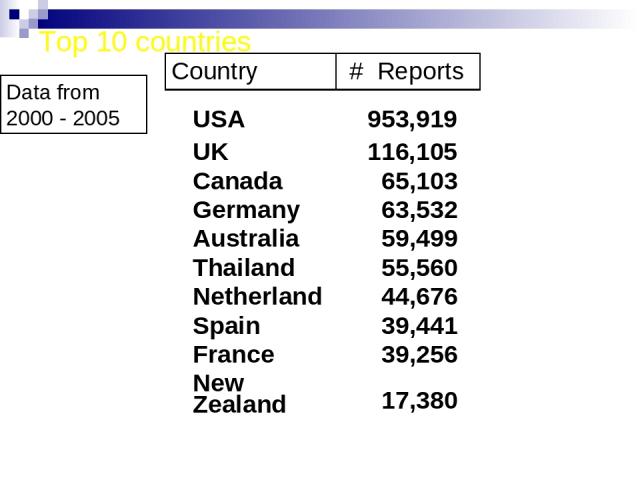
Top 10 countries Data from 2000 - 2005 USA 953,919 UK 116,105 Canada 65,103 Germany 63,532 Australia 59,499 Thailand 55,560 Netherland 44,676 Spain 39,441 France 39,256 New Zealand 17,380 Country # Reports

Деятельность ФЦМБЛС Росздравнадзора Осуществляется практическая и научно-методическая работа с целью совершенствования выявления, оценки и профилактики нежелательных последствий применения лекарственных средств
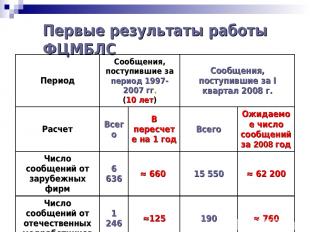
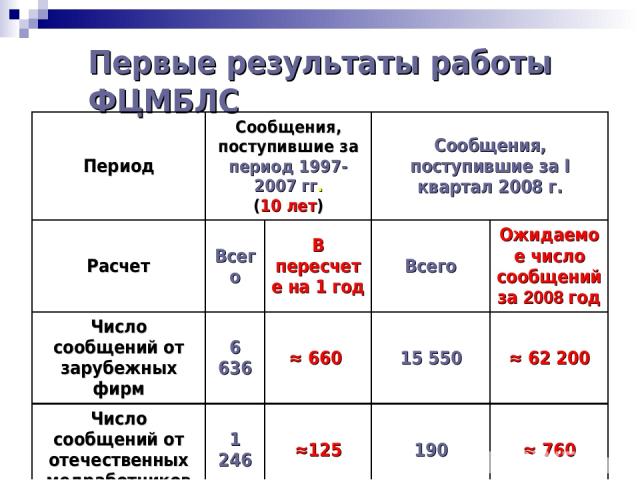
Первые результаты работы ФЦМБЛС Период Сообщения, поступившие за период 1997-2007 гг. (10 лет) Сообщения, поступившие за I квартал 2008 г. Расчет Всего В пересчете на 1 год Всего Ожидаемое число сообщений за 2008 год Число сообщений от зарубежных фирм 6 636 ≈ 660 15 550 ≈ 62 200 Число сообщений от отечественных медработников 1 246 ≈125 190 ≈ 760

ЧТО следует делать регуляторным органам здравоохранения и фармацевтическим компаниям для улучшения работы фармаконадзора с целью обеспечения безопасности больных: Проводить активные пост маркетинговые наблюдения и исследования препаратов Проводить образовательные и тренинговые семинары для персонала системы фармаконадзора Обеспечить активный тренинг и контроль побочных явлений в соответствие со специальными процедурами Обеспечить непрерывное предоставление информации о препаратах ( научные публикации, конгрессы, письма-предостережения и т.д. Играть более активную роль в повышении осознания значимости проблемы

Обеспечить непрерывное образование в области неблагоприятных побочных реакций на лекарственные средства Формировать понимание значимости спонтанной системы сбора информации Обеспечить обратную связь (информировать медицинский и фармацевтический персонал о результатах анализа поступающих от них сообщений, предоставлять им дополнительную информацию о НПР) ЧТО следует делать для вовлечения медицинских и фармацевтических работников в работу по фармаконадзору:

Для развития фармаконадзора в России срочно необходимо: активизация российских медицинских работников по сбору информации о неблагоприятных побочных реакциях на лекарственные средства, повышение ответственности производителей (особенно отечественных) за мониторинг безопасности лекарственных средств;

Вы можете облегчить страдания и спасти жизнь тысячам пациентов, сделав одну простую вещь - своевременно сообщите о подозреваемой неблагоприятной побочной реакции (НПР), в региональный или федеральный центр мониторинга безопасности лекарственных средств.

XIV Конгресс «Человек и лекарство», 2007

Безопасность больных – это не только вопрос денег и не только вопрос технологий Ни деньги, ни технологии, ни приказы не решат наших проблем. Центральное значение имеют политическая воля руководства и профессиональная и гражданская ответственность работников здравоохранения.

Безопасность больных – это не только глобальная проблема, это важная составная часть национальной безопасности страны

Федеральный центр мониторинга безопасности лекарственных средств Официальный адрес (для корреспонденции): Москва, 127051, Петровский бульвар, д.8. Фактический адрес: Москва, 123182, ул. Щукинская, д.6. Телефон: 8 (495) 234-61-04 * 3086, * 3093,*3091 Факс: 8 (499) 190-34-61 Сайт в интернете: www.regmed.ru (раздел «Фармаконадзор») Адрес электронной почты для сообщений о НПР: [email protected]