Презентация на тему: Железо


I. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. I. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. II. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА. IV. ХИМИЧЕСКИЕ СВОЙСТВА


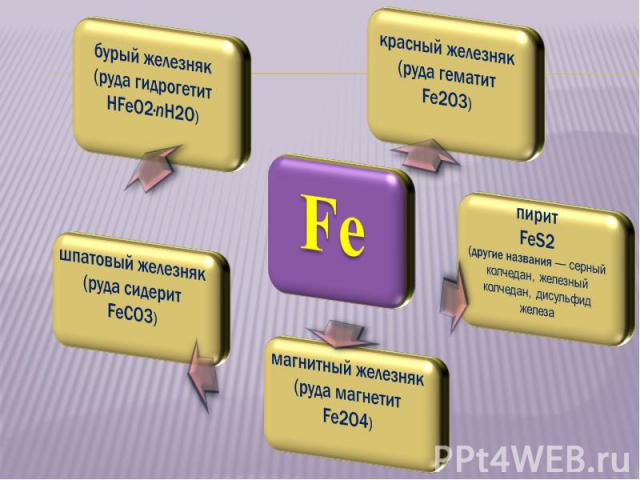
В земной коре железо распространено достаточно широко. В земной коре железо распространено достаточно широко. На его долю приходится: Около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10–5 — 1·10–8% железа.
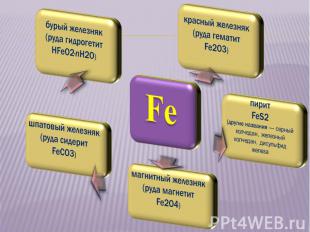

БУРЫЙ ЖЕЛЕЗНЯК (РУДА ГИДРОГЕТИТ НFeO2 · nH2O)

ШПАТОВЫЙ ЖЕЛЕЗНЯК ШПАТОВЫЙ ЖЕЛЕЗНЯК (РУДА СИДЕРИТ FeСO3)

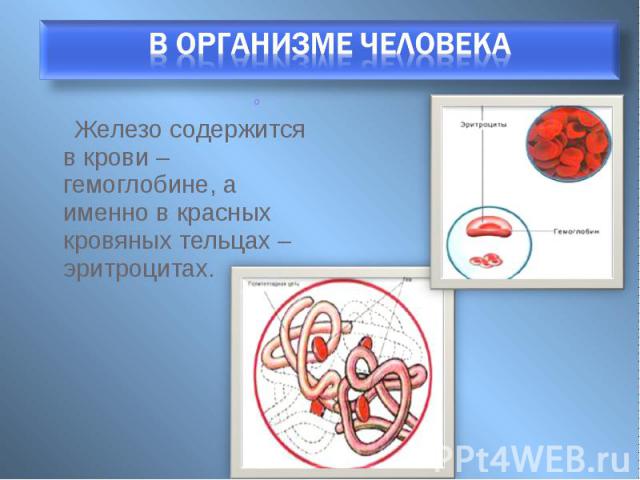
Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах. Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах.

Железо влияет на процесс фотосинтеза. Железо влияет на процесс фотосинтеза.

Из железа Из железа изготавливают различные виды транспорта


В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т. д. В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т. д.

Железо - сравнительно мягкий ковкий серебристо-серый металл. Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения около 2800 0С При температуре ниже 770 0С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».

Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2e=Fe+2 Fe-3e=Fe+3 Электронные структуры 3d- и 4s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так:

Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2 = Fe2O3 • FeO (Феррит железа) 2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3

3. Взаимодействие с простыми веществами: 3. Взаимодействие с простыми веществами: 3.1 Горит в кислороде 3 Fe + 2 O2 =Fe3 O4 3.2 Реагирует с хлором 2Fe + 3 Cl2 = 2FeCl3 3.3 Взаимодействует с серой Fe + S = FeS

4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4 = FeSO4 + Cu 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4 = FeSO4 + Cu 5. При высокой температуре (700-900°С) железо реагирует с парами воды: 3Fe+4Н2O=Fe3O4+4Н2

С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): Fe + 2HCl = FeCl2 + H2 Fe + H2SO4 = FeSO4 + H2 С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции. Растворяется железо в разбавленной азотной кислоте. 8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O

При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2 8.Соединения железа (III) в растворах восстанавливаются металлическим железом: Fe + 2FeCl3 = 3FeCl2

1. Проявляет основные свойства, взаимодействуя с кислотами: 1. Проявляет основные свойства, взаимодействуя с кислотами: FeO+H2SO4 = FeSO4 + H2O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: МnO + Fe2O3 =Mn (FeO2)2
![FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнб FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнб](https://fs1.ppt4web.ru/images/95274/121154/310/img20.jpg)
FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] = KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурь FeCI3 + 3 KCNS = Fe(CNS )3 +3KCI кроваво-красный

Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде. Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.



















![FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] = KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурь FeCI3 + 3 KCNS = Fe(CNS )3 +3KCI кроваво-красный FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] = KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурь FeCI3 + 3 KCNS = Fe(CNS )3 +3KCI кроваво-красный](https://fs1.ppt4web.ru/images/95274/121154/640/img20.jpg)












