Презентация на тему: Тема: “Загальна характеристика основ”.

Тема: “Загальна характеристика основ”.

Мета уроку: 1. Познайомити учнів з новим класом неорганічних сполук – основами. 2. Розглянути класифікацію, склад та номенклатуру основ. 3.Фізичні та хімічні властивості 4. Зстосування основ в побуті

Будова основ та їх назви Класифікація Фізичні властивості Хімічні властивості Застосування в побуті та промисловості Правила поводження з лугами

Основи Основи – це складні речовини, в яких йони металів з’єднані з одною чи декільками гідроксид-йонами.
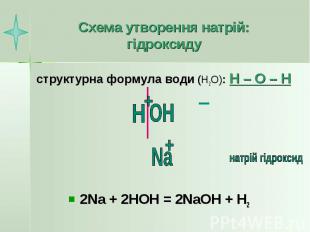
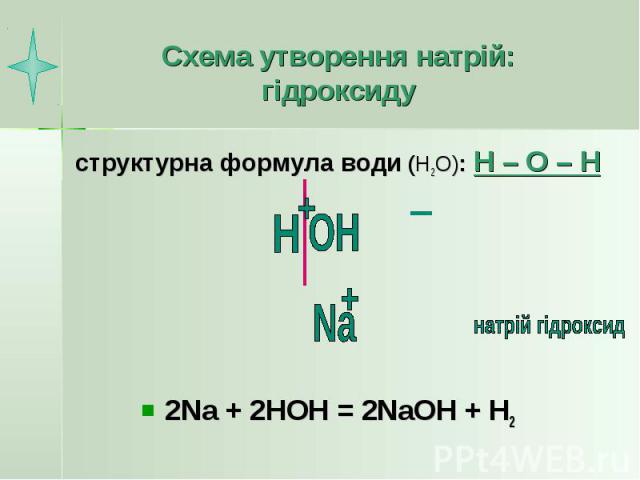
Схема утворення натрій: гідроксиду структурна формула води (Н2О): Н – О – Н 2Na + 2HOH = 2NaOH + H2

Оксидам металів відповідають основи: Складіть основи з оксидів: ZnO, Li2O, MgO. Спробуйте самостійно скласти оксиди з основ: CuOH, Cu(OH)2

Номенклатура: Ca(OH)2 –кальций гідроксид Fe(OH)2 – ферум (ІІ) гідроксид Fe(OH)3 – ферум (ІІІ) гідроксид
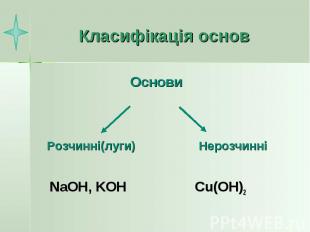
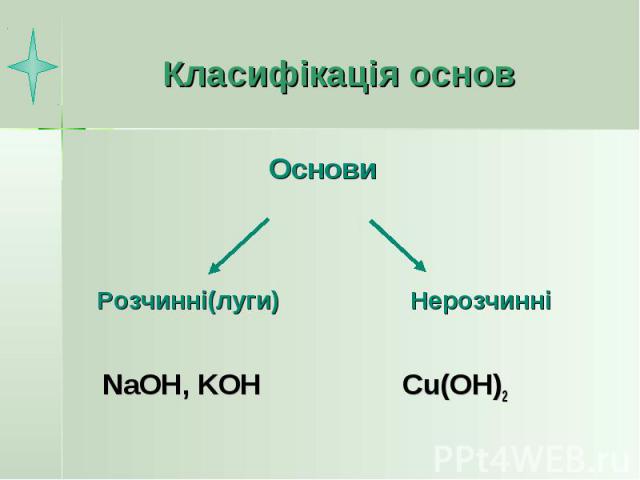
Класифікація основ NaOH, KOH Cu(OH)2

Фізичні властивості основ :Калій гідроксид

Кальцій гідроксид

Купрум(ІІ) гідроксид

Ферум(ІІ) гідроксид

Фізичні властивості основ: Тверді,кристалічні Ті,що утворюються під час реакцій Луги(розчинні) дуже їдкі Мають різні кольори

Хімічні властивості Взаємодіють з індикаторами: Фенол-фталеїн – малиновий Лакмус- синій

Взаємодіють з кислотами KOH+HCl= KCl+H2O Взаємодіють з кислотними оксидами 2KOH+CO2 =K2CO3+H2O Взаємодіють з солями KOH+NaCl=KCl+NaOH Нерозчинні розкладаються при нагріванні Сu(OH)2=CuO+H2O

Добування В лабораторії: Розчиненням лужних металів у воді 2Na+2H2O=2NaOH+H2 CaO+H2O=Ca(OH)2 В промисловості електролізом розплавів нерозчинні основи добувають дією НР основ на солі: СuSO4+KOH=Cu(OH)2+K2SO4

Застосування NaOH – для виробництва мила,ліків, в текстильній промисловості, очищування нафти. KOH - в аккумуляторах. Ca(OH)2 (гашене вапно)– у виробництві цукру, соди, в будівництві, для приготування бордоської суміші – засобу для боротьби з хворобами та шкідниками рослин.
Значення у побуті

Домашнє завдання: Прочитати §, § 6,11 Виконати завдання: 57,102