Презентация на тему: Соли. Названия и классификация солей


Общая формула класса: MenAm





В зависимости от состава соли бывают: В зависимости от состава соли бывают: 1. Средние – продукт полного замещения водорода в кислоте металлом. 2KOH + H2CO3 = K2CO3 + 2H2O карбонат калия 2. Кислые - продукт неполного замещения водорода в кислоте металлом. NaOH + H2CO3 = NaHCO3 + H2O гидрокарбонат натрия

3. Основные – продукт неполного замещения групп OH- основания на кислотный остаток. 3. Основные – продукт неполного замещения групп OH- основания на кислотный остаток. Mg(OH)2 + HCl = MgOHCl + H2O гидроксохлорид магния 4. Двойные – состоящие из различных атомов металлов и общего кислотного остатка. K2SO4 + Al2(SO4)3 = 2KAl(SO4)2 сульфат алюминия - калия

5. Смешанные – состоящие из общего металла и различных кислотных остатков. 5. Смешанные – состоящие из общего металла и различных кислотных остатков. CuOHNO3 + CH3COOH = CuCH3COONO3 + H2O нитрат-ацетат меди (II) 6. Комплексные – содержащие сложные ионы. K4 [Fe(CN)6] жёлтая кровяная соль
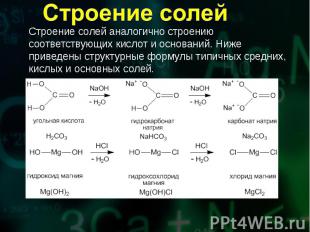

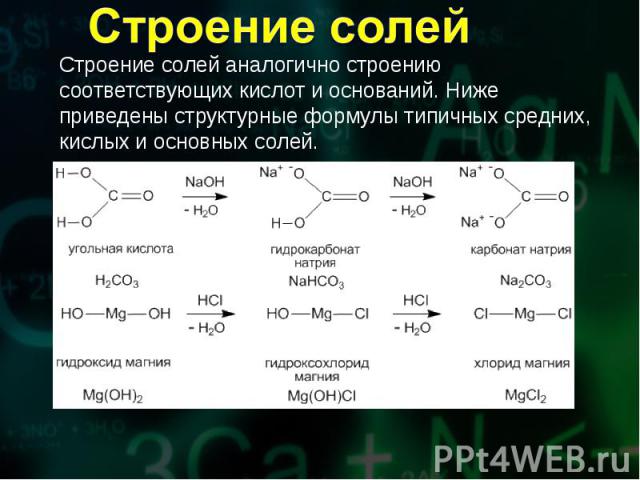
Соли получают при химическом взаимодействии соединений различных классов и простых веществ. Соли получают при химическом взаимодействии соединений различных классов и простых веществ. Отметим важнейшие способы получения солей.

1. Реакция нейтрализации: 1. Реакция нейтрализации: Ca(OH)2 + H2CO3 = = CaCO3 + 2H2O карбонат кальция

2. Взаимодействие металлов с неметаллами: 2. Взаимодействие металлов с неметаллами: 2Al + 3S = Al2S3 сульфид алюминия

3. Взаимодействие металлов с кислотами: 3. Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2 хлорид цинка

4. Взаимодействие основных оксидов с кислотными оксидами. 4. Взаимодействие основных оксидов с кислотными оксидами. CaO + SiO2 = CaSiO3 силикат кальция 5. Взаимодействие оснований с кислотными оксидами. Ca(OH)2 + CO2 = CaCO3 + H2O карбонат кальция

Соли, за небольшим исключением, являются твёрдыми кристал-лическими веществами различного цвета. По растворимости в воде их делят на: Соли, за небольшим исключением, являются твёрдыми кристал-лическими веществами различного цвета. По растворимости в воде их делят на: растворимые малорастворимые нерастворимые

Соли взаимодействуют: Соли взаимодействуют: C простыми веществами – металлами и неметаллами. со сложными – кислотами, основаниями и солями.

1. С металлами: 1. С металлами: CuSO4 + Fe = FeSO4 + Cu сульфат меди (II) сульфат железа (II) 2. С неметаллами: 2KI + Br2 = 2KBr + I2 иодид калия бромид калия

3. С кислотами: 3. С кислотами: 2NaCl + H2SO4 = хлорид натрия = Na2SO4 + 2HCl сульфат натрия

4. С щелочами: 4. С щелочами: FeCl2 + 2NaOH = хлорид железа (II) =Fe(OH)2 + 2NaCl хлорид натрия

5. С солями: 5. С солями: AgNO3 + KCl = нитрат серебра =AgCl + KNO3 хлорид серебра

Многие соли применяют в быту (поваренная соль, сода), в качестве минеральных удобрений, при производстве стекла, моющих средств, взрывчатых веществ. Многие соли применяют в быту (поваренная соль, сода), в качестве минеральных удобрений, при производстве стекла, моющих средств, взрывчатых веществ.