Презентация на тему: Соединение азота. Оксиды азота

Соединение азота. Оксиды азота

Азот способен проявлять несколько степеней окисления от -3 до +5.Известны несколько оксидов азота.+1 +2 +3 +4 +5Солеобразующие: N2O3 NO2 N2O4 N2O5 димер оксида азота(IV) Несолеобразующие: N2O NOВсе оксиды азота, кроме N2O, ядовитые вещества.

N2O- оксид азота (I)Степень окисления не всегда совпадает с валентностью +2 -2N=N=O степень окисления распределяется на два атома азота и равна для обоих +2, а для одного +1 Бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворим в воде, но не взаимодействует с ней. В смеси с кислородом используется в медицине для слабого наркоза. («веселящий» газ)При 700 С разлагается: 2N2O= 2N2 + O2

NO-оксид азота (II) II IIN=О молекула линейна, имеет неспаренный электрон, поэтому является радикалом, используется как донор электронов. Окислительно-восстановительная двойственностьВосстановитель:2NO + O2 = 2NO2 (легко!)так как радикал, очень легко подвергается окислениюОкислитель:2NO + 2SO2 = 2SO3 + N2Нитрозный способ получения серной кислотыБесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре: N2 + O2 2NO В лаборатории: Сu + HNO3 == Cu(NO3)2 + NO + H2O разб.

N2O3-оксид азота (III)Кислотный оксид:Приведите примеры реакций, доказывающих кислотные свойства оксида азота(III)N2O3 + H2O = 2HNO2N2O3 + 2 KOH = 2 KNO2 = H2O жидкость, темно – синего цвета, неустойчива при низких температурах и разлагается: N2O3 = NO + NO2

Оксид азота (IV) Кислотный оксид:Взаимодействие с водой происходит таким образом, так как это смешанный оксид, которому соответствует две кислотыНиже 22 С молекулы оксида азота(IV) легко соединяются попарно и образуют бесцветную жидкость состава N2O4 , которая при охлаждении до -10,2 С превращается в бесцветные кристаллы«Лисий хвост» Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.

Оксид азота (V)Кислотный оксид: Легко разлагается (при нагревании – со взрывом): 2N2O5 == 4NO2 + O2 Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты : N2O5 + H2O == 2HNO3Нестойкие кристаллы: 2N2O5 ==4NO2 + O2Как и оксид азота(III) практического значения не имеет

Обобщающие задания. 1.Имеются три закрытых цилиндра: с оксидом азота (IV), с азотом, с аммиаком.Как проще всего узнать, в каком цилиндре какой газ содержится?В каких цилиндрах и как изменится окраска влажной фиолетовой лакмусовой бумажки?
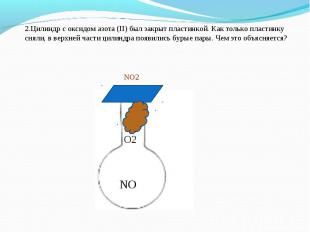
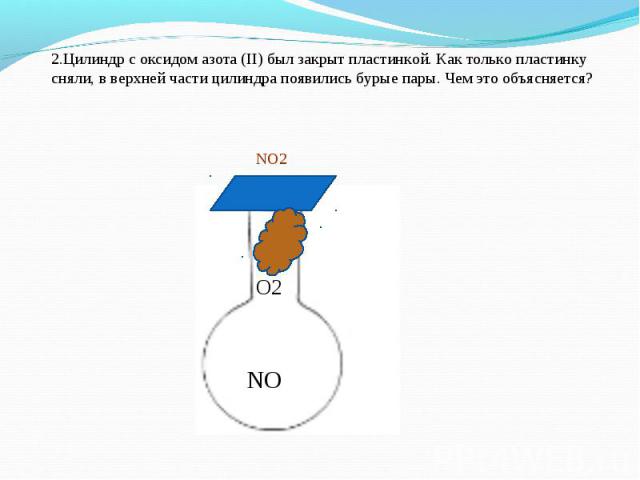
2.Цилиндр с оксидом азота (II) был закрыт пластинкой. Как только пластинку сняли, в верхней части цилиндра появились бурые пары. Чем это объясняется?