Презентация на тему: Применение аммиака

Аммиак Физиологическое действие, использование, производство и получение.

Использование в сельском хозяйстве.
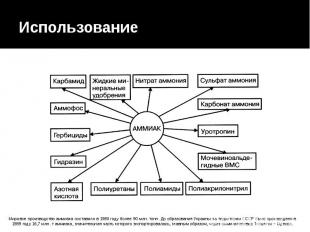
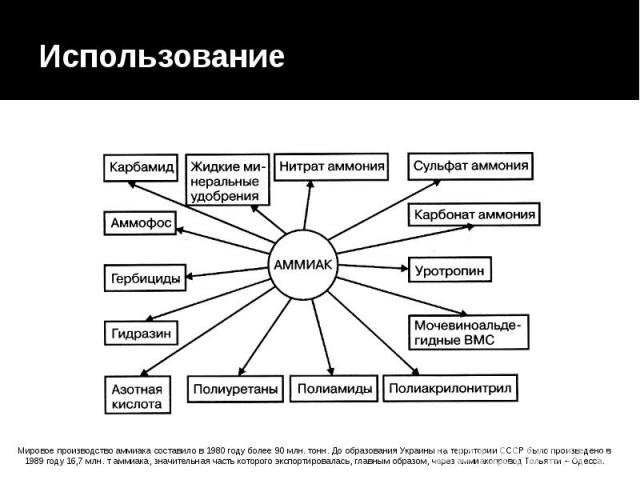
Использование

Как можно получить аммиак Аммиак можно получить нагреванием смеси соли хлорида аммония и гидрооксида кальция. При нагревании смеси происходит реакция образования соли, аммиака и воды. 2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
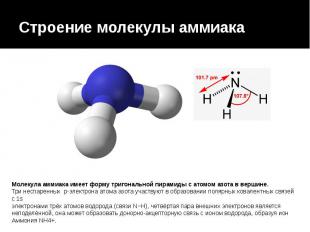
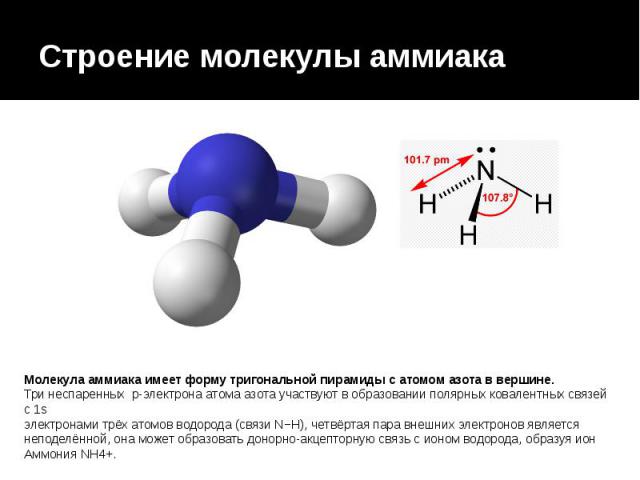
Строение молекулы аммиака Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион Аммония NH4+.

Жидкий аммиак

Производство На производство одной тонны аммиака расходуется в среднем 1200 нм³ природного газа, в Европе — 900 нм³. Белорусский «Гродно Азот» расходует 1200 нм³ природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 нм³. Украинские производители потребляют от 750 нм³ до 1170 нм³ природного газа на тонну аммиака. По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну аммиака.

Спасибо за ваше внимание!