Презентация на тему: Презентация на тему :«Уксусная кислота»

Презентация на тему : «Уксусная кислота» Выполнила: ученица 11-Б класса Зануда Т.А Проверила: учитель химии Тисленко Л.А

Уксусная кислота. Уксусная кислота СН3СООН– самая древняя из органических кислот. Аптекари – алхимики средневековья получали её из перебродившего вина. Чистая уксусная кислота – б/ц жидкость с резким запахом. Она используется в пищевых целях, при консервировании пищевых продуктов.

История открытия кислоты Уксусная кислота известна с древнейших времен, так как образуется при скисании вин (винный уксус). Водный разбавленный раствор этого вещества называется уксусом. Слово «уксус» происходит от греческого слова «oxys», означающего «кислый». В древности уксус был единственной пищевой кислотой, получаемой при скисании виноградного вина, и это объясняет, что его название древними греками отождествлялось с самим представлением о кислом, кислоте. В России уксус называли «кислой влажностью» или «древесной кислотой». Это связано с получением уксусной кислоты при сухой перегонке древесины лиственных пород, прежде всего березы. Получение уксуса при сухой перегонке древесины описано в сочинениях Иоганна Глаубера и Роберта Бойля

Характеристика Уксусная кислота принадлежит к слабым кислотам. Она во всех отношениях смешивается с водой, спиртом, эфиром, бензолом и нерастворима в сероуглероде. При разбавлении уксусной кислоты водой происходит сокращение объёма раствора.
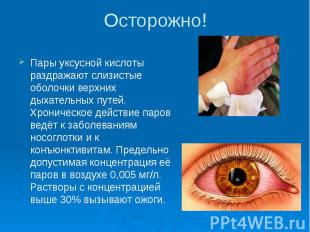
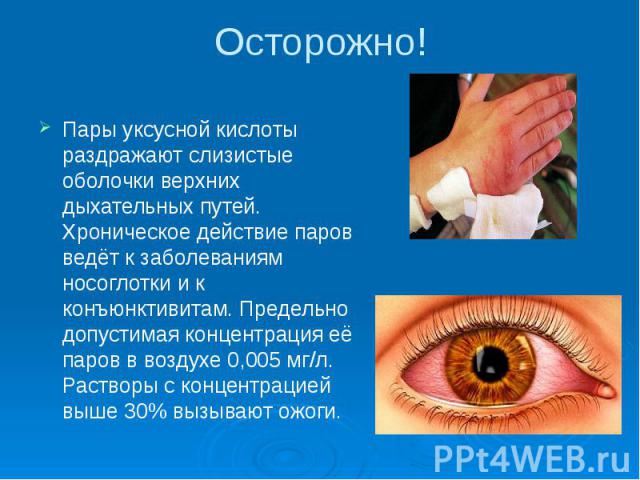
Осторожно! Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Хроническое действие паров ведёт к заболеваниям носоглотки и к конъюнктивитам. Предельно допустимая концентрация её паров в воздухе 0,005 мг/л. Растворы с концентрацией выше 30% вызывают ожоги.

Химические свойства С сильными металлами Mg + 2CH3COOH → (CH3COO)2Mg + H2 С солями CH3COOH + NaHCO3 = CH3COONa + H2O + CO2 Диссоциация СН3СООН → Н+ + СН3СООˉ Реакция нейтрализации CH3COOH + NaOH --> CH3COONa + H2О

Гидрирование Гидрирование С2H2+2H20=CH3COOH+H2↑ Окисление С оксидами CH3COOH+MgO=(CH3COO)2+2H2O Реакция этерификации CH3COOH+C2H5OH=CH3COOC2H5+H2O

Физические свойства Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Агрегатное состояние Жидкое Цвет Бесцветная прозрачная жидкость Запах Резкий уксусный Растворимость в воде Хорошая Температура кипения 1180С Температура плавления 170С
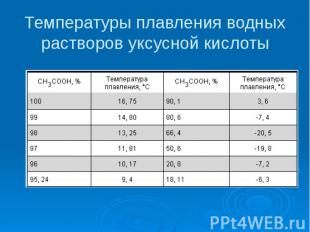
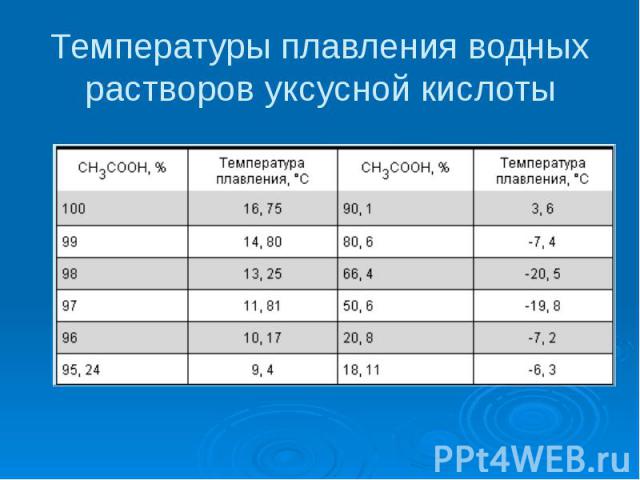
Температуры плавления водных растворов уксусной кислоты

Применение уксусной кислоты Значительные количества уксусной кислоты идут на производство ацетона, ацетилцеллюлозы, синтетических красителей, используются при крашении и печатании тканей и в пищевой промышленности. Основные соли уксусной кислоты Al, Fe, Cr и другие служат протравами при крашении; они обеспечивают прочную связь красителя с текстильным волокном.


Их широко применяют как растворители (особенно этилацетат) для нитроцеллюлозных лаков, глифталевых и полиэфирных смол, в производстве киноплёнки и целлулоида, а также в пищевой промышленности и парфюмерии. В производстве полимеров значительную роль играют искусственные волокна, лаки и клеи на основе винилацетата. Их широко применяют как растворители (особенно этилацетат) для нитроцеллюлозных лаков, глифталевых и полиэфирных смол, в производстве киноплёнки и целлулоида, а также в пищевой промышленности и парфюмерии. В производстве полимеров значительную роль играют искусственные волокна, лаки и клеи на основе винилацетата.