Презентация на тему: Метал



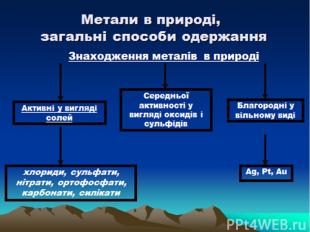
Положення металів в П.С. Коли в П. С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали (до ним також відносяться елементи побочних підгруп). Елементи, разміщені поблизу діагоналі (наприклад, берилій Be, алюміній Al, титан Ti, германій Ge, ніобій Nb, сурма Sb та інші.), володіють подвійними властивостями. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.

В давні часи і середні віки були відомі тільки сім металів.Це число відносилось з числом відомих на той час числом планет: Солнце (золото), Юпітер (олово), МІСЯЦЬ (срібро), Марс (залізо), Меркурій (ртуть), Сатурн (свинець), Венера (мідь). Алхімікі вважали,що під впливом променей планет в надрах Землі народжуються ці метали.



Періодична система Д. І. Менделєєва

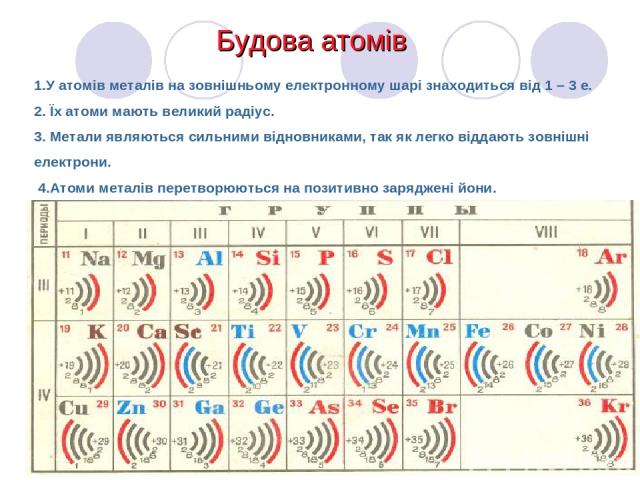
Будова атомів металів Кристалічні гратки, в вузлах яких знаходяться позитивно заряджені йони і деяке число нейтральних атомів, між якими рухаються вільні електрони , називають металічними. Цей звязок ,який здійснюють ці відносно вільні електрони між йонами металів, які утворюють кристалічну гратку , називають металічною.
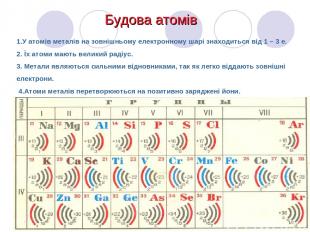
1.У атомів металів на зовнішньому електронному шарі знаходиться від 1 – 3 е. 2. Їх атоми мають великий радіус. 3. Метали являються сильними відновниками, так як легко віддають зовнішні електрони. 4.Атоми металів перетворюються на позитивно заряджені йони. Будова атомів
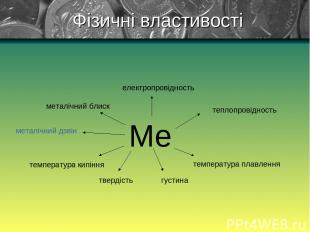
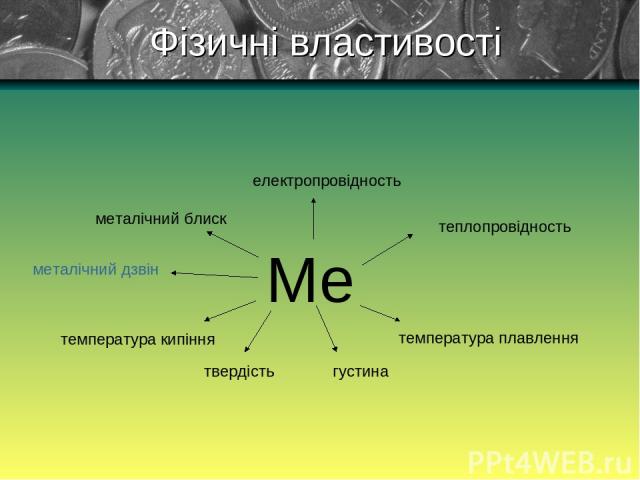
Фізичні властивості

1) Для всіх металів характерний металічний блиск, сірий колір і непрозорість пояснюються наявністю вільних електронів . 2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо. Фізичні властивості Електричний струм– це напрямлений рух заряджених частинок.


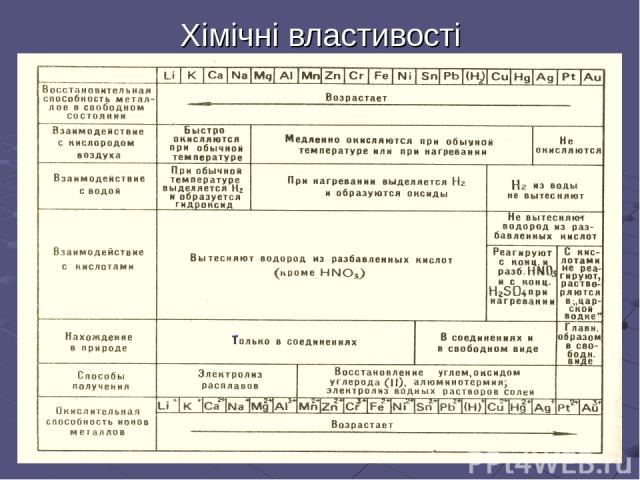
Хімічні властивості

Загальні хімічні властивостію. Найбільш активно метали реагують з простими речовинами (неметалами): галогенами киснем сіркою Ca - відновник Mg - відновник Na - відновник

4) Метали, гідроксиди яких амфотерні, як правило взаємодіють з розчинами кислот і лугів. Основна властивість металів – вони відновники. 5) Метали можуть утворювати хімічні сполуки між собою.Вони мають загальну назву – інтерметалічні сполуки або інтерметаліди. Прикладом є сполуки деяких металів з сурмою: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них найчастіше всього не зберігаються ступені окиснення, характерні в сполуках з неметалами. Загальні хімічні властивості .

Загальні хімічні властивості (продовження) Метали можуть окиснюватися також йонами Гідрогену та йонами інших металів. Метали реагують з складними речовинами : водою: кислотами: растворами солей: Na - відновник Fe - відновник Zn - відновник

Електрохімічний ряд напруг Цей ряд називається електрохімічним рядом напруг. Енергія іонізаціі, визначається положенням металу в періодичній системі. В електрохімічному ряду напруг метал, який стоїть лівіше, може витіснити із розчину або розплаву солей метал, який стоїть правіше.Користуючись цим рядом, можно передбачити, як Ме буде себя вести в парі з іншим . В електрохімічному ряді напруг розміщений Гідроген .Це дозволяє зробити висновок про Ме ,які можуть витіснити водень із розчинів кислот. Так , наприклад, залізо витісняє водень із розчинів кислот, так как знаходиться лівіше нього; мідь же не витісняє водень, так как знаходиться правіше нього.

Корозія металів Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища. Існує два види корозії: хімічна і електрохімічна . Електрохімічна корозія Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей. Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Методи боротьби з корозією





Царь – пушка (бронза)

Царь-дзвін (бронза)