Презентация на тему: Медь, серебро, золото

Химия элементов. Лекция 8 Общая характеристика элементов IБ-группы. Медь. Серебро 900igr.net
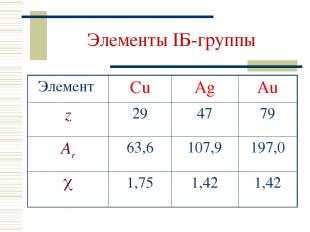
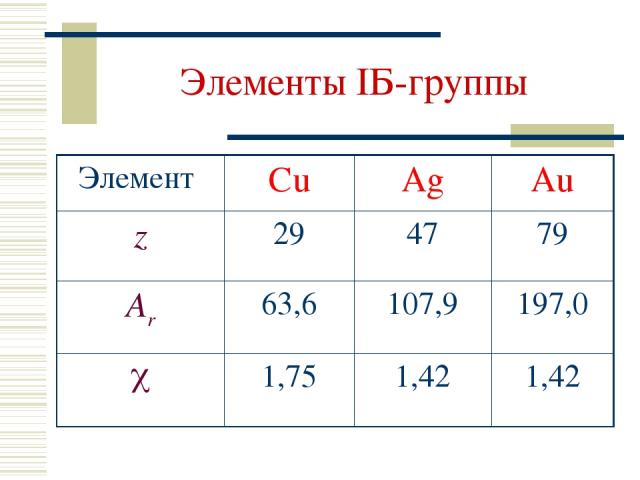
Элементы IБ-группы Элемент Cu Ag Au z 29 47 79 Ar 63,6 107,9 197,0 1,75 1,42 1,42
![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления](https://fs3.ppt4web.ru/images/132073/183651/310/img2.jpg)
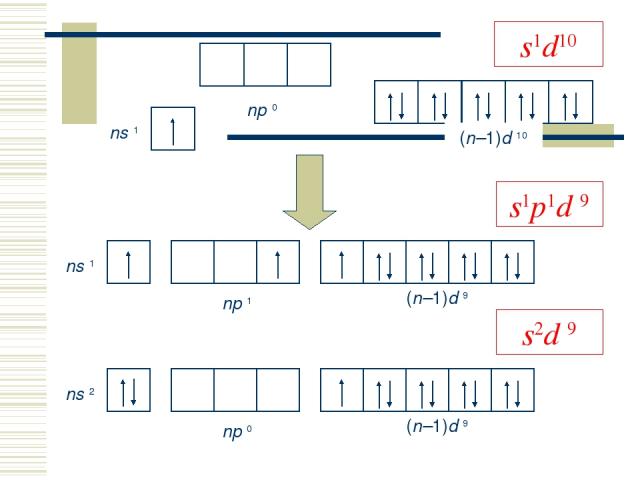
Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)
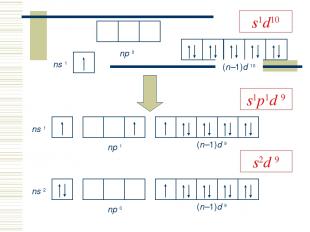
s2d 9 s1p1d 9

Степени окисления +I (d10ns0) +II (d9ns0) +III (d8ns0) Cu Cu2SO4, CuCl Cu(+II) уст. ст. окисления NaCuO2 Ag Ag(I) уст. ст. окисления AgCO3, AgF2 AgF3 Au Au2S, AuBr – Au(+III) уст. ст. окисления
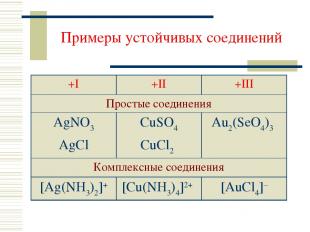
Примеры устойчивых соединений +I +II +III Простые соединения AgNO3 AgCl CuSO4 CuCl2 Au2(SeO4)3 Комплексные соединения [Ag(NH3)2]+ [Cu(NH3)4]2+ [AuCl4]–

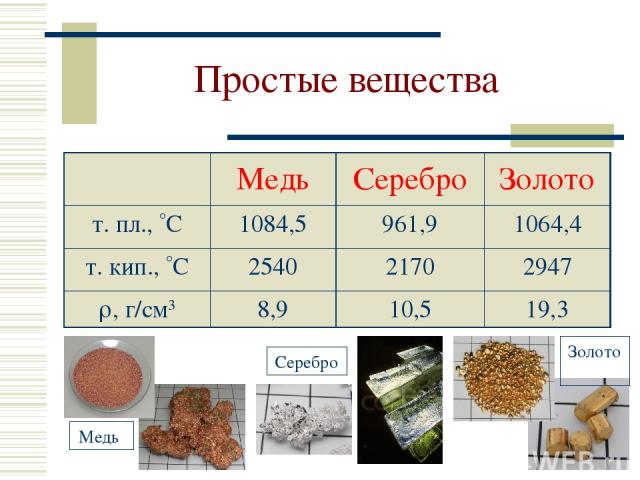
Простые вещества Медь Серебро Золото т. пл., С 1084,5 961,9 1064,4 т. кип., С 2540 2170 2947 , г/см3 8,9 10,5 19,3
![В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ](https://fs3.ppt4web.ru/images/132073/183651/310/img7.jpg)
В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ + H2O ЭIБ + H3O+ CuAg H2SO4(конц.) HNO3(конц.) HNO3(разб.) Cu2+ Ag+

Химическое растворение В «царской водке» (до ст. ок. +III) Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O В расплаве селеновой кислоты (до ст. ок. +III) 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O В щелочной среде (до ст. ок. +I) 2Cu + 8(NH3.H2O) + O2 = = 2[Cu(NH3)4]2+ + 4OH + 6H2O 2Cu + 4CN + 2H2O = 2[Cu(CN)2] + 2OH + H2 4Ag + 8CN + 2H2O + O2 = 4[Ag(CN)2] + 4OH

Кислородные соединения Cu Ag, Au +I: Cu2O уст. красн., т. пл. 1240 С +II: CuO черн., разл. до Cu2O и O2 (1026 С) Cu(OH)2 синий, амфотерн., разл. до CuO и H2O (40-80 С) +III: Cu2O3 т-ра разл. 400 С (до CuO и O2 ) +I: Ag2O разл. до Ag и O2 (160 С ) +II: «Ag2O2» (AgIAgIIIO2) диамагнитен, разл. до Ag2O и O2 (100 С) +III: Au2O3 амфотерн., разл. до Au и O2 (160 С) Au2O3 · 2H2O амфотерный (Kк Kо) – «золотая кислота»
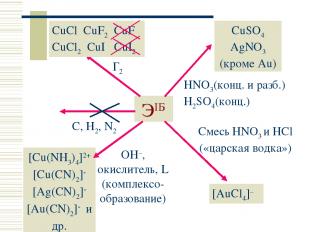
ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц. и разб.) H2SO4(конц.) Смесь HNO3 и HCl («царская водка») [AuCl4]– OH–, окислитель, L (комплексо-образование) [Cu(NH3)4]2+ [Cu(CN)2] [Ag(CN)2] [Au(CN)2] и др. Простые вещества

Распространение в природе и важнейшие минералы В земной коре: 26. Cu 0,01% масс. 69. Ag 1·10–5 % масс. 75. Au 5·10–5 % масс.

Минералы халькопирит (FeCu)S2 халькозин Cu2S ковеллин CuS куприт Cu2O малахит Cu2(CO3)2(OH)2 аргентит Ag2S хлораргирит AgCl калаверит AuTe2

Получение меди 2(FeIIICuI)S2 + 5 O2 + 2SiO2 = 2Cu0 + 2FeSiO3 + 4SO2 халькопирит…обжиг/связывание FeII ………шлак……. газ Cu+I + 1e– = Cu0 Fe+III + 1e– = Fe+II 2S–II – 12e– = 2S+IV O2 + 4e– = 2O–II Выплавляемую «черновую» медь рафинируют электролитически.

Выплавка меди Рафинирование меди электролизом Загрузка печи Пульт управления Очищенная медь

Добыча золота
![Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] + Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] +](https://fs3.ppt4web.ru/images/132073/183651/310/img16.jpg)
Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] + OH измельч.руда….……………..воздух……р-р, рН > 7, выделение HCN (гидролиз) 2[Э(CN)2] + Zn(тв., пыль) = [Zn(CN)4]2 + 2Э(т) Zn + 2HCl = ZnCl2 + H2 (удаление избытка Zn)

Особенности химии меди 2Cu+I Cu0 + Cu2+ Cu2O + H2SO4 = = Cu0 + CuSO4 + H2O Cu2O + 2HCl = 2CuCl + H2O CuCl + HCl = H[CuCl2] Cu2O + 4(NH3·H2O) = = 2[Cu(NH3)2]OH + 3H2O КЧ(CuI) = 2, sp-гибр. Получение: 4Cu(OH)2 + N2H4·H2O = = 2Cu2O + N2 + 7H2O

Гидроксид Cu(OH)2 Получение: Cu2+ + 2OH─ = Cu(OH)2 Амфотерность: Cu(OH)2 + 2H3O+ = = [Cu(H2O)4]2+ Cu(OH)2 + 2OH = = [Cu(OH)4]2 Cu(OH)2 = CuO + H2O синий черный t°
![Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O](https://fs3.ppt4web.ru/images/132073/183651/310/img19.jpg)
Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O Длинные транс-связи: Cu–N: 205 пм, Cu–O: 337 пм [Cu(NH3)6]2+ можно получить в среде жидкого аммиака в воде условно для [CuL4]2+ КЧ(CuII) = 4, dsp2-гибр. (квадрат) см. эффект Яна-Теллера sp3d2, искаж. октаэдр
![Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(N Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(N](https://fs3.ppt4web.ru/images/132073/183651/310/img20.jpg)
Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] sp3 (тетраэдр): [Cu(OH)4]2 (в усл. изб. щелочи, рН 11) Аммиачный к-с меди(II): получение и разрушение
![Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu](https://fs3.ppt4web.ru/images/132073/183651/310/img21.jpg)
Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu2+ + I– + e–= CuI (CuII – мягкий окислитель) 2I– – 2e– = I2 В р-ре: [I(I)2]–, CuI (суспензия) I2 + 2SO3S2– = 2I– + S4O62– Растворение за счет комплексообразования: CuI(т) + 2 SO3S2–= [Cu(SO3S)2]3– + I– CuI(т) + 2Na2SO3S = Na3[Cu(SO3S)2] + NaI

Серебро Ag – уникальный элемент: нет гидратов солей нет аквакомплексов Растворимые соли: AgNO3, AgClO4, AgClO3, AgF Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = = [Ag(NH3)2]X + 2H2O (КЧ 2) AgX(т) + 2Na2SO3S = Na3[Ag(SO3S)2] (КЧ 2)

Серебро 2Ag+ + 2OH– Ag2O(т) + H2O ПР(AgOH) = 1,6 ·10–6 2Ag+ + S2– = Ag2S(т) ПР(Ag2S) = 6,3 ·10–50 4Ag + 2H2S + O2 = 2Ag2S + 2H2O (почернение серебряных предметов)


![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр) Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)](https://fs3.ppt4web.ru/images/132073/183651/640/img2.jpg)

![Примеры устойчивых соединений +I +II +III Простые соединения AgNO3 AgCl CuSO4 CuCl2 Au2(SeO4)3 Комплексные соединения [Ag(NH3)2]+ [Cu(NH3)4]2+ [AuCl4]– Примеры устойчивых соединений +I +II +III Простые соединения AgNO3 AgCl CuSO4 CuCl2 Au2(SeO4)3 Комплексные соединения [Ag(NH3)2]+ [Cu(NH3)4]2+ [AuCl4]–](https://fs3.ppt4web.ru/images/132073/183651/640/img5.jpg)
![В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ + H2O ЭIБ + H3O+ CuAg H2SO4(конц.) HNO3(конц.) HNO3(разб.) Cu2+ Ag+ В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au , В: +0,34 +0,799 +1,00 ЭIБ + H2O ЭIБ + H3O+ CuAg H2SO4(конц.) HNO3(конц.) HNO3(разб.) Cu2+ Ag+](https://fs3.ppt4web.ru/images/132073/183651/640/img7.jpg)
![Химическое растворение В «царской водке» (до ст. ок. +III) Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O В расплаве селеновой кислоты (до ст. ок. +III) 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O В щелочной среде (до ст. ок. +I) 2Cu + 8(NH3.H2O) + O2 = = 2[… Химическое растворение В «царской водке» (до ст. ок. +III) Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O В расплаве селеновой кислоты (до ст. ок. +III) 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O В щелочной среде (до ст. ок. +I) 2Cu + 8(NH3.H2O) + O2 = = 2[…](https://fs3.ppt4web.ru/images/132073/183651/640/img8.jpg)

![ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц. и разб.) H2SO4(конц.) Смесь HNO3 и HCl («царская водка») [AuCl4]– OH–, окислитель, L (комплексо-образование) [Cu(NH3)4]2+ [Cu(CN)2] [Ag(CN)2] [Au(CN)2] и др. Простые вещества ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц. и разб.) H2SO4(конц.) Смесь HNO3 и HCl («царская водка») [AuCl4]– OH–, окислитель, L (комплексо-образование) [Cu(NH3)4]2+ [Cu(CN)2] [Ag(CN)2] [Au(CN)2] и др. Простые вещества](https://fs3.ppt4web.ru/images/132073/183651/640/img10.jpg)





![Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] + OH измельч.руда….……………..воздух……р-р, рН > 7, выделение HCN (гидролиз) 2[Э(CN)2] + Zn(тв., пыль) = [Zn(CN)4]2 + 2Э(т) Zn + 2HCl = ZnCl2 + H2 (удаление избытка Zn) Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 [Э(CN)2] + OH измельч.руда….……………..воздух……р-р, рН > 7, выделение HCN (гидролиз) 2[Э(CN)2] + Zn(тв., пыль) = [Zn(CN)4]2 + 2Э(т) Zn + 2HCl = ZnCl2 + H2 (удаление избытка Zn)](https://fs3.ppt4web.ru/images/132073/183651/640/img16.jpg)
![Особенности химии меди 2Cu+I Cu0 + Cu2+ Cu2O + H2SO4 = = Cu0 + CuSO4 + H2O Cu2O + 2HCl = 2CuCl + H2O CuCl + HCl = H[CuCl2] Cu2O + 4(NH3·H2O) = = 2[Cu(NH3)2]OH + 3H2O КЧ(CuI) = 2, sp-гибр. Получение: 4Cu(OH)2 + N2H4·H2O = = 2Cu2O + N2 + 7H2O Особенности химии меди 2Cu+I Cu0 + Cu2+ Cu2O + H2SO4 = = Cu0 + CuSO4 + H2O Cu2O + 2HCl = 2CuCl + H2O CuCl + HCl = H[CuCl2] Cu2O + 4(NH3·H2O) = = 2[Cu(NH3)2]OH + 3H2O КЧ(CuI) = 2, sp-гибр. Получение: 4Cu(OH)2 + N2H4·H2O = = 2Cu2O + N2 + 7H2O](https://fs3.ppt4web.ru/images/132073/183651/640/img17.jpg)
![Гидроксид Cu(OH)2 Получение: Cu2+ + 2OH─ = Cu(OH)2 Амфотерность: Cu(OH)2 + 2H3O+ = = [Cu(H2O)4]2+ Cu(OH)2 + 2OH = = [Cu(OH)4]2 Cu(OH)2 = CuO + H2O синий черный t° Гидроксид Cu(OH)2 Получение: Cu2+ + 2OH─ = Cu(OH)2 Амфотерность: Cu(OH)2 + 2H3O+ = = [Cu(H2O)4]2+ Cu(OH)2 + 2OH = = [Cu(OH)4]2 Cu(OH)2 = CuO + H2O синий черный t°](https://fs3.ppt4web.ru/images/132073/183651/640/img18.jpg)
![Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O Длинные транс-связи: Cu–N: 205 пм, Cu–O: 337 пм [Cu(NH3)6]2+ можно получить в среде жидкого аммиака в воде условно для [CuL4]2+ КЧ(CuII) =… Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O Длинные транс-связи: Cu–N: 205 пм, Cu–O: 337 пм [Cu(NH3)6]2+ можно получить в среде жидкого аммиака в воде условно для [CuL4]2+ КЧ(CuII) =…](https://fs3.ppt4web.ru/images/132073/183651/640/img19.jpg)
![Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] sp3 (тетраэдр): [Cu(OH)4]2 (в усл. изб. щелочи, рН 11) Аммиачный к-с меди(II): получение и разрушение Комплексные соединения dsp2 (квадрат): [Cu(H2O)2(OH)4]2–, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] sp3 (тетраэдр): [Cu(OH)4]2 (в усл. изб. щелочи, рН 11) Аммиачный к-с меди(II): получение и разрушение](https://fs3.ppt4web.ru/images/132073/183651/640/img20.jpg)
![Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu2+ + I– + e–= CuI (CuII – мягкий окислитель) 2I– – 2e– = I2 В р-ре: [I(I)2]–, CuI (суспензия) I2 + 2SO3S2– = 2I– + S4O62– Растворение за счет комплексообразования: CuI(т… Окислительно-восстановительные свойства 2[Cu(H2O)4]2+ + 4I = 2CuI + I2 + 8H2O Cu2+ + I– + e–= CuI (CuII – мягкий окислитель) 2I– – 2e– = I2 В р-ре: [I(I)2]–, CuI (суспензия) I2 + 2SO3S2– = 2I– + S4O62– Растворение за счет комплексообразования: CuI(т…](https://fs3.ppt4web.ru/images/132073/183651/640/img21.jpg)
![Серебро Ag – уникальный элемент: нет гидратов солей нет аквакомплексов Растворимые соли: AgNO3, AgClO4, AgClO3, AgF Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = = [Ag(NH3)2]X + 2H2O (КЧ 2) AgX(т) + 2Na2SO3S = Na3[Ag(SO3S)2] (КЧ 2) Серебро Ag – уникальный элемент: нет гидратов солей нет аквакомплексов Растворимые соли: AgNO3, AgClO4, AgClO3, AgF Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = = [Ag(NH3)2]X + 2H2O (КЧ 2) AgX(т) + 2Na2SO3S = Na3[Ag(SO3S)2] (КЧ 2)](https://fs3.ppt4web.ru/images/132073/183651/640/img22.jpg)












