Презентация на тему: Кремний

МБОУ Балтасинская гимназия IV группа главная подгруппа « КРЕМНИЙ» Подготовила: Хафизова Э.М. Учитель химии I кв. категории . 900igr.net

Общая характеристика кремния по положению в периодической системе Порядковый номер – 14, заряд ядра +14, протонов в ядре – 14, электронов – 14. Номер периода III – 14 электронов движутся по трём энергетическим уровням. Номер группы IV – на внешнем энергетическом уровне находятся 4 электрона. Радиус атома больше чем у углерода – увеличивается способность к отдаче электронов. Увеличиваются металлические и восстановительные свойства (в сравнении с углеродом).

Строение атома кремния

До завершения внешнего уровня кремнию не хватает 4 электронов. В соединениях может проявлять степени окисления +4, -4. 4Na + Si = Na4Si Si0 + 4e- = Si-4 пр.Red ; Ox Na0 - 1e- = Na+1 пр.Ox ; Red Si + O2 = SiO2 Si0 – 4e- = Si+4 пр.Ox ; Red 2O0 + 2e- = 2O-2 пр.Red ; Ox


Кремний в природе В свободном виде не встречается. Встречается, преимущественно, в виде диоксида кремния (SiO2), другое его название кремнезем. В виде SiO2 входит в состав растительных и животных организмов. В природе образует минерал кварц, который имеет разновидности, такие, как горный хрусталь, агат, опал, яшма, халцедон, сердолик.

Один из типов природных соединений кремния – силикаты. Среди них наиболее распространены алюмосиликаты. К алюмосиликатам относятся гранит, глина, слюда. К силикатам, не содержащим алюминий, относится асбест.

Значение для живых организмов Важнейшее соединение кремния – оксид SiO2 необходим для жизни растений и животных. Он придаёт прочность стеблям растений и защитным покровам животных. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем. У человека кремний придаёт гладкость и прочность костям

История открытия кремния Кремний был открыт в 1811 году Гей – Люссаком и Тенаром, но он был слишком загрязнён примесями. В 1825 году был получен чистый кремний шведским химиком Берцелиусом.

Получение кремния В лабораториях кремний получают, восстанавливая оксид кремния SiO2 магнием. SiO2 + 2Mg = 2MgO + Si Si+4 + 4e- = Si0 пр. Red ; Ox Mg0 - 2e- = Mg+2 пр. Ox ; Red В промышленности получают в электрических печах, коксом восстанавливая SiO2 или разложением силана. SiO2 + 2C = 2CO + Si (1900 0) Si+4 + 4e- = Si0 пр. Red ; Ox C0 - 2e- = C-2 пр. Ox ; Red SiH4 = Si + 2H2 (400 0) Si-4 - 4e- = Si0 пр. Ox ; Red 2H+1 + 1e- = 2H0 пр. Red ; Ox

Кремний – простое вещество В реакциях выступает в роли окислителя : В этом случае он взаимодействует с металлами и водородом. В реакциях выступает в роли восстановителя: В этом случае он будет взаимодействовать с более электроотрицательными веществами (O2 , Cl2 Br2 ) Кристаллическое вещество тёмно-серого цвета, полупроводник. За счёт кристаллической решётки, он очень твёрдый.

Физические свойства При кристаллизации из газовой фазы на поверхностях с температурой ниже 600 °С образуется аморфный кремний. Это одна из аллотропных модификаций кремния. Аморфный кремний по свойствам напоминает резину, но он гораздо прочнее. Также он активнее кристаллического кремния. Для кристаллического кремния температура плавления 1415 °С (плавится с уменьшением объема на 9%), температура кипения 3249 °С .Он имеет металлический блеск.

Оксид кремния (IV) Оксид кремния IV – кислотный оксид, отличается от других кислотных оксидов тем, что не взаимодействует с водой, кремниевая кислота нерастворима в воде. Обладает всеми свойствами кислотных оксидов: взаимодействует с основными оксидами и основаниями. Отличается высокой температурой плавления и довольно низкой химической активностью. активностью. Кристаллическая решетка Оксида кремния (IV)

В соединениях кремний проявляет степени окисления +4, 0, -4. Он химически мало активен, большей активностью обладает аморфный кремний. При повышении температуры активность его увеличивается, и он вступает в реакцию с металлами, неметаллами, со сложными неорганическими веществами.

Взаимодействие с металлами Кремний растворим в расплавах металлов, причём с некоторыми из них ( Zn, Al, Sn, Pb, Ag, Au и т.д.) не реагирует, а с другими (Na, K, Ca и т.д.) – образует силициды 4Na + Si = Na4 Si – сплавление Na0 - 1e- = Na+1 пр. Ox ; Red Si0 + 4e- = Si-4 пр. Red ; Ox

Кремний взаимодействует с неметаллами, которые более электроотрицательны, и с галогенами. Si + O2 = SiO2 Si0 – 4e- = Si+4 пр. Ox ; Red 2O0 + 2e- = 2O-2 пр. Red ; Ox Si + 2Cl2 = SiCl4 Si0 – 4e- = Si+4 пр. Ox ; Red 2Cl0 + 1e- = 2Cl-1 пр. Red ; Ox Взаимодействие с неметаллами

Со щелочами взаимодействует при малых количествах ионов ОН – (Возможен гидролиз стекла при хранении щелочей в стеклянной посуде). Si + 2NaOH + H2O = Na2SiO3 + 2H2 Si0 – 4e- = Si+4 пр. Ox ; Red 2H+1 + 1e- = 2H0 пр. Red ; Ox Взаимодействие со щелочами

СИЛИЦИДЫ Твёрдые вещества неустойчивые по отношению к воде и растворам кислот, под действием которых необратимо гидролизуют с выделением силана. Mg2Si + 4H2O = Mg(OH)2↓ + SiH4↑ Mg2Si+ 4HCl = 2MgCl2 + SiH4 Mg2Si + 4H+ = 2Mg2+ + SiH4

Силикаты – соли кремниевой кислоты Силикаты можно получить сплавлением диоксида кремния с оксидами металлов или с карбонатами. Силикаты натрия и калия называют растворимым стеклом. Их водные растворы – хорошо известный силикатный клей. SiO2 + CaO = CaSiO3 SiO2 + CaCO3 = CaSiO3 + CO2

Кремниевая кислота Действием на силикаты сильными кислотами(HNO3 , H2SO4) получают кремниевую кислоту H2SiO3 . Она очень слабая и нерастворима в воде (выпадает в виде студенистого осадка, иногда заполняющего весь объём раствора, превращая его в желе). При высыхании его образуется силикагель, широко применяемый в качестве адсорбента – поглотителя других веществ.

ПРИМЕНЕНИЕ Кремний применяют для полупроводниковых материалов, а также для кислотоупорных сплавов. Из расплавленного кварца делают химическую посуду. Из каолина и нефелина получают алюминий. Из глины делают цветочные горшки и посуду. Из песка делают стекло. Не менее важным продуктом является цемент. Кремний используется в солнечных батареях.

При сплавлении кварцевого песка с углём при высоких температурах образуется карбид кремния SiC ,который по твёрдости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней. Хотя уже в глубокой древности люди использовали кремний в соединениях, потому что при сколах он образовывал режущие края.

Силикатная промышленность Силикатная промышленность – отрасль промышленности, занимающаяся переработкой природных соединений кремния. Область применения кремния очень велика. Из него получают оконное, ламповое, зеркальное и другие виды стекла. Другим важным материалом, на основе соединений кремния, является цемент. Его получают спеканием известняка и глины в специальных печах. Всем этим занимается силикатная промышленность, а ещё производством кирпича, фарфора, фаянса.
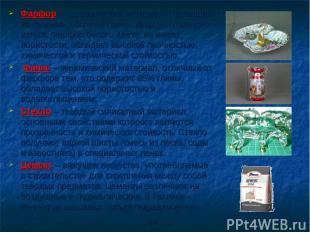
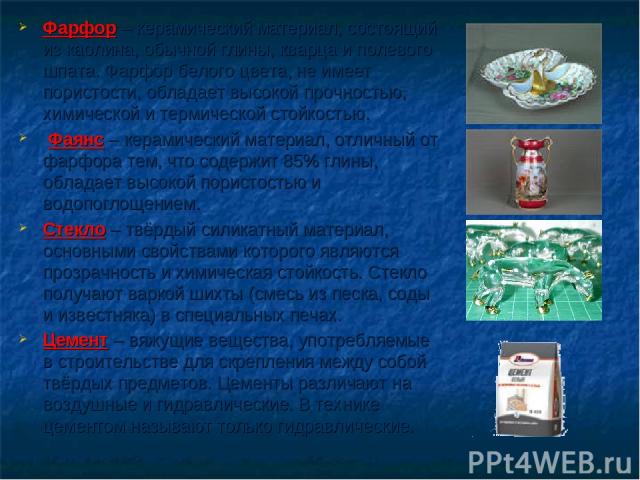
Фарфор – керамический материал, состоящий из каолина, обычной глины, кварца и полевого шпата. Фарфор белого цвета, не имеет пористости, обладает высокой прочностью, химической и термической стойкостью. Фаянс – керамический материал, отличный от фарфора тем, что содержит 85% глины, обладает высокой пористостью и водопоглощением. Стекло – твёрдый силикатный материал, основными свойствами которого являются прозрачность и химическая стойкость. Стекло получают варкой шихты (смесь из песка, соды и известняка) в специальных печах. Цемент – вяжущие вещества, употребляемые в строительстве для скрепления между собой твёрдых предметов. Цементы различают на воздушные и гидравлические. В технике цементом называют только гидравлические.

Керамика Стекло Цемент строительная листовое быстротвердеющий бытовая стеклоизделия расширяющийся тонкая строительно- морозостойкий техническая технические жаропрочный изделия Продукция силикатной промышленности