Презентация на тему: Кремний и его соединения

900igr.net

Дать общую характеристику элементу кремний. Рассмотреть природные соединения кремния. Провести сравнительный анализ с соединениями углерода. Изучить свойства кремния. Цели урока: Кто хочет съесть ядро ореха, должен расколоть его скорлупу.

План характеристики: Открытие кремния нахождение в природе Строение и свойства атомов Получение кремния Физические свойства кремния Химические свойства кремния Соединения кремния Применение кремния

Открытие кремния Кремний был впервые открыт в 1811 году Гей-Люссаком и Тенаром. Он является одним из наиболее распространенных в земной коре элементов. Массовая доля кремния составляет 27,6%. В природе встречается в виде оксидов, силикатов и алюмосиликатов.

Кремний его 26% в природе по распространению в земной коре занимает 2-е место после кислорода его оксиды являются основной частью песка и глины в виде кристаллов входит в состав горных пород образует бесцветные кристалла кварца и горного хрусталя на его основе создано промышленное производство керамики, стекла, цемента полупроводник

Сверху вниз: Гранат. Лунный камень. Амазонит (полевой шпат, алюмосиликат калия КАlSi3О8) - красивый поделочный камень из Ильменских гор (Урал).

Входит также в состав растений и животных. Анализ образцов лунного грунта показал наличие SiO2 в количестве более 40%.




Строение и свойства атомов

Физические свойства кремния Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. Кристаллическая решетка кремния напоминает структуру алмаза. Полупроводник. tплав(Si)=1415 ˚C, tплав(алмаз)=3730 ˚C.

Получение кремния Лабораторный способ: SiO2+2Mg=Si+2MgO Промышленный способ: SiO2+2C=2CO+Si SiCL4 + 2Zn = Si + 2ZnCL2

Химические свойства кремния а) восстановительные 1) Si + O2 =SiO2 2) Si + 2CL2 = SiCL4 3) Si + S = SiS2 4)Si + 2H2O (пар) = SiO2 + H2 5)Si + C = SiC (карборунд) 6)Si +2NaOH(конц) + H2O = Na2SiO3 + H2 б) окислительные Si + 2Ca = Ca2Si

Соединения кремния SiH4 силан – бесцветный газ -получают косвенно, действуя на силициды металлов водой или кислотами: Mg2Si + 4H2O = 2Mg(OH)2 + SiH4 -менее стоек по сравнению с CH4, самовоспламеняется при обычной температуре: SiH4 + 2O2 =SiO2 + 2H2O
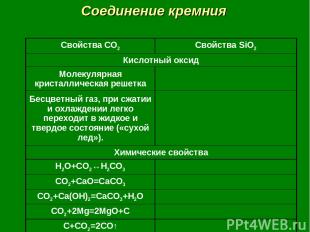
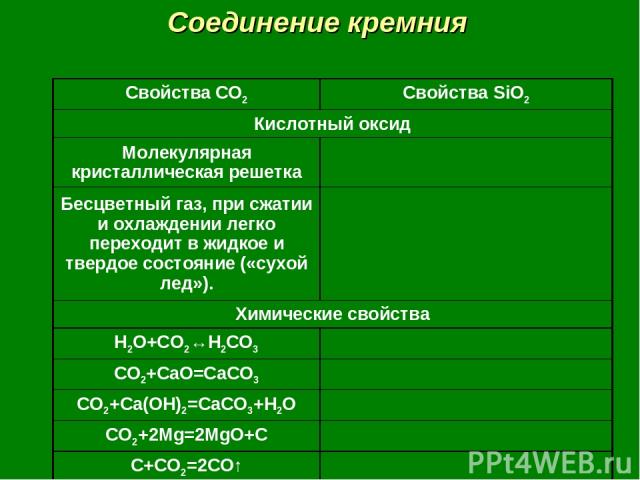
Соединение кремния Свойства CO2 Свойства SiO2 Кислотный оксид Молекулярная кристаллическая решетка Бесцветный газ, при сжатии и охлаждении легко переходит в жидкое и твердое состояние («сухой лед»). Химические свойства H2O+CO2↔H2CO3 CO2+CaO=CaCO3 CO2+Ca(OH)2=CaCO3+H2O CO2+2Mg=2MgO+C C+CO2=2CO↑

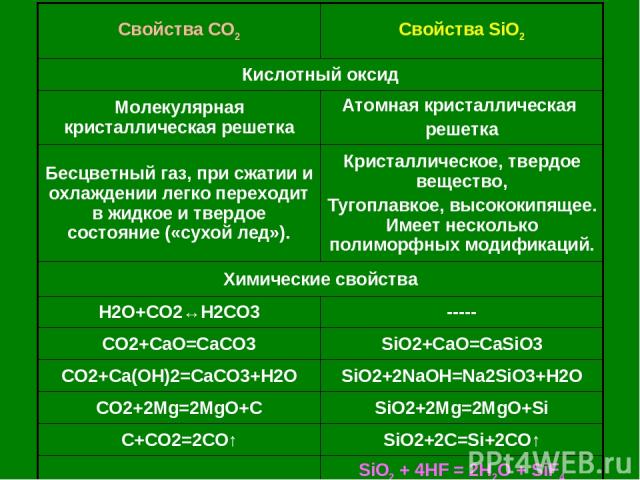
Свойства CO2 Свойства SiO2 Кислотный оксид Молекулярная кристаллическая решетка Атомная кристаллическая решетка Бесцветный газ, при сжатии и охлаждении легко переходит в жидкое и твердое состояние («сухой лед»). Кристаллическое, твердое вещество, Тугоплавкое, высококипящее. Имеет несколько полиморфных модификаций. Химические свойства H2O+CO2↔H2CO3 ----- CO2+CaO=CaCO3 SiO2+CaO=CaSiO3 CO2+Ca(OH)2=CaCO3+H2O SiO2+2NaOH=Na2SiO3+H2O CO2+2Mg=2MgO+C SiO2+2Mg=2MgO+Si C+CO2=2CO↑ SiO2+2C=Si+2CO↑ SiO2 + 4HF = 2H2O + SiF4

Кремниевая кислота и её соли Получить кремниевую кислоту можно только из её солей: Na2SiO3 + 2HCl = 2NaCL +H2SiO3 SiO32- + 2H+ = H2SiO3 Выделить в чистом виде нельзя,.т.к. при нагревании она разлагается: H2SiO3 = SiO2 + H2O соли кремниевой кислоты называют силикатами. Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами: SiO2 + CaO = CaSiO3 SiO2 + CaCO3 = CaSiO3 + CO2

Силикаты На силикаты приходится более 1/4 массы всей земной коры. К ним относится около 500 минералов, в т.ч. важнейшие породообразующие: полевые шпаты, слюды, пироксены и др. силикаты – это и песок, и глина, и кирпич, и стекло, и цемент, и эмаль, и тальк, и асбест, и изумруд, и топаз.

Применение соединений кремния Стекло Оконное стекло Na2CO3 + CaCO3 + 6SiO2 = Na2O .CaO .6SiO2 Хрусталь K2O . PbO . 6SiO2

Керамика Применение соединений кремния Из керамики изготавливают изоляторы для высоковольтных ЛЭП и другие изделия, используемые в технике, строительстве, быту и т.п.

Керамика - общее название многочисленных материалов, полученных при спекании глин с различными минеральными добавками. Значит, и кирпич - керамика, и кафель, и осколки древнегреческой амфоры - тоже керамика. Современная посуда из керамики

Кремний в отличии от углерода в свободном виде в природе не встречается. Кремний может быть, как окислителем так и восстановителем. Оксид кремния в отличии от оксида углерода (IV) с водой не взаимодействует. Кремний - полупроводник, его соединение используют для получения стекла, цемента, бетона, а также для получения кирпича, фарфора, фаянса и изделия из них. Выводы: