Презентация на тему: КОВАЛЕНТНАЯ СВЯЗЬ

Химическая связь 11 класс

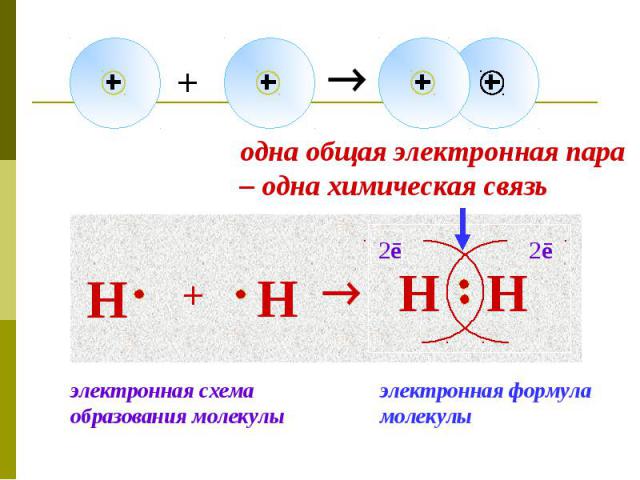
Ковалентная связь - это химическая связь, возникающая между атомами за счет образования общих электронных пар.

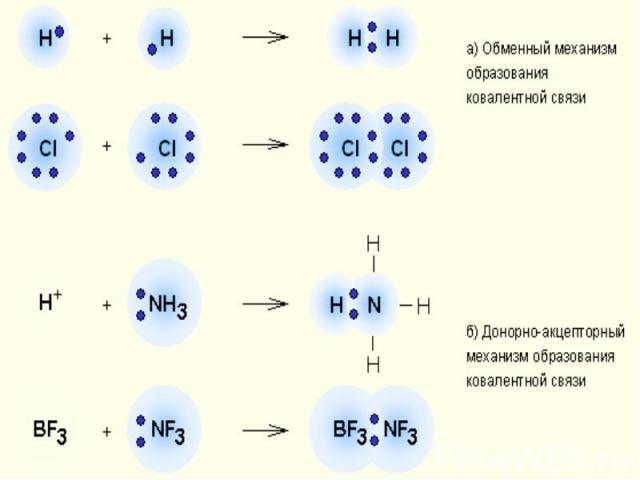
Классификация КС 1. По механизму образования
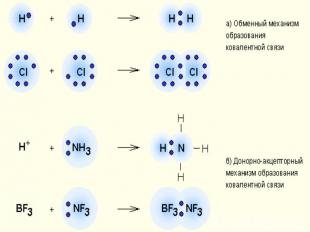
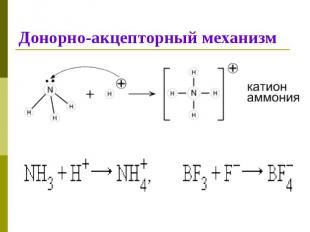
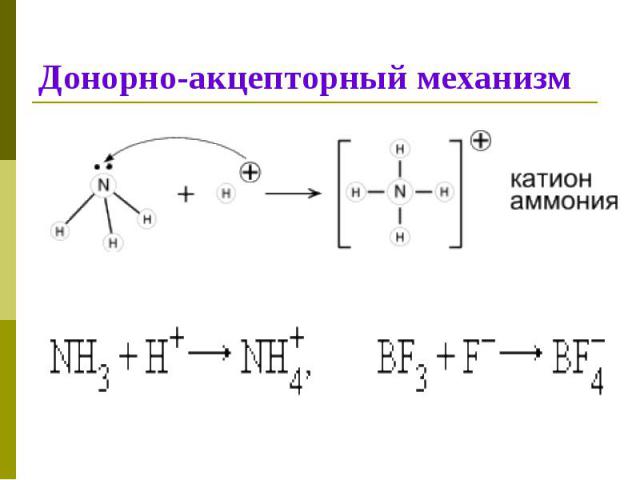
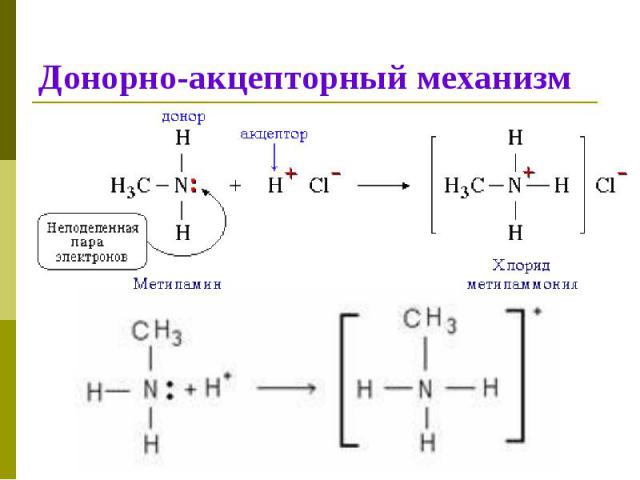
Донорно-акцепторный механизм
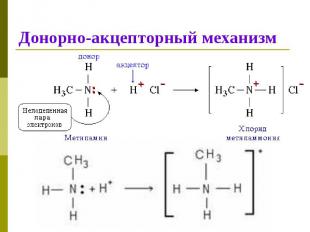
Донорно-акцепторный механизм
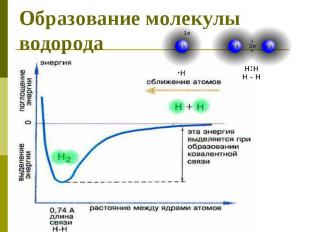
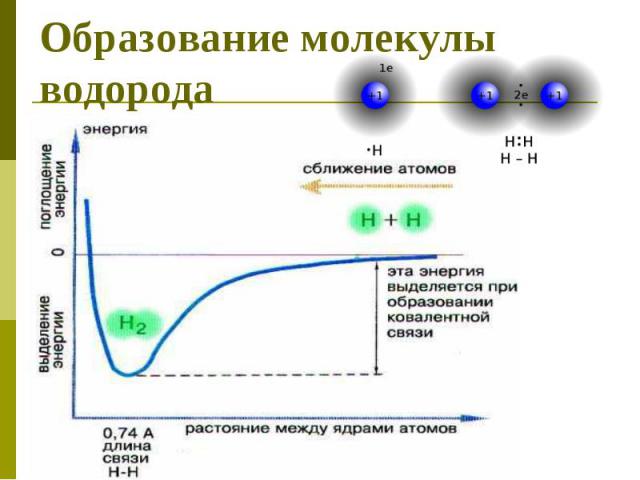
Образование молекулы водорода
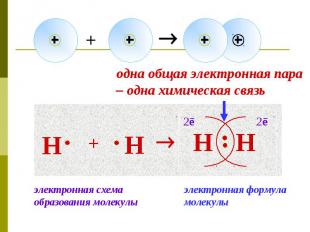
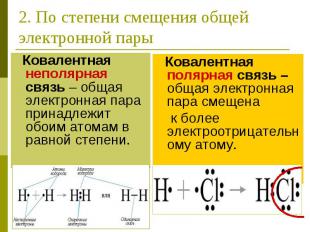
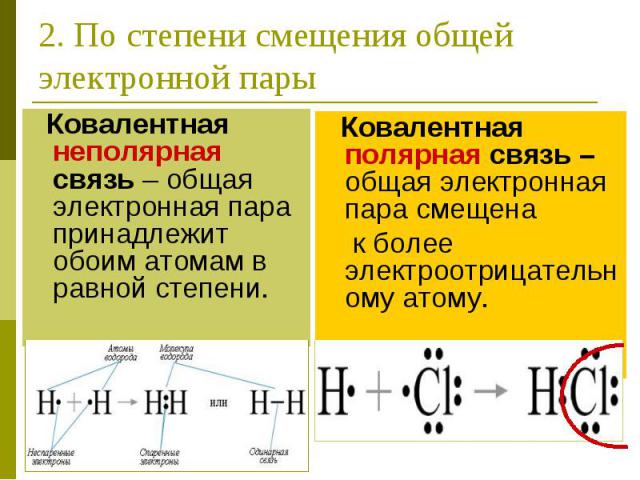
2. По степени смещения общей электронной пары Ковалентная неполярная связь – общая электронная пара принадлежит обоим атомам в равной степени.
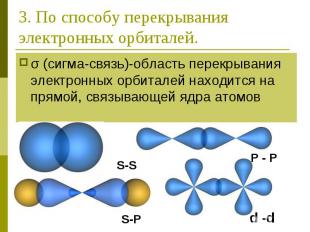
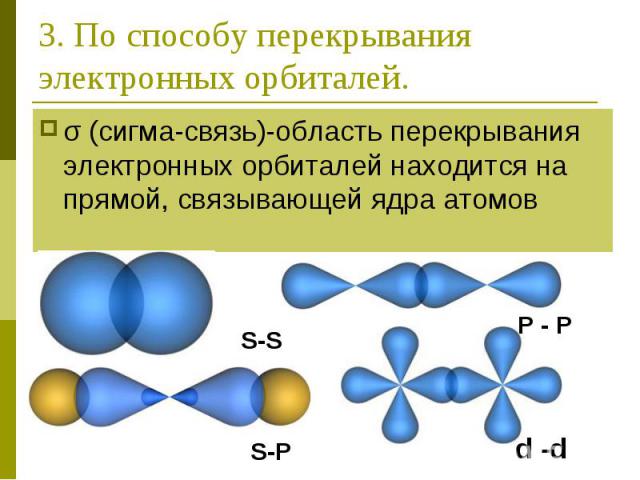
3. По способу перекрывания электронных орбиталей. σ (сигма-связь)-область перекрывания электронных орбиталей находится на прямой, связывающей ядра атомов

3. По способу перекрывания электронных орбиталей π (пи-связь)-область перекрывания электронных орбиталей лежит вне прямой, связывающей ядра атомов
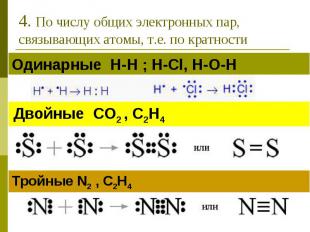
4. По числу общих электронных пар, связывающих атомы, т.е. по кратности

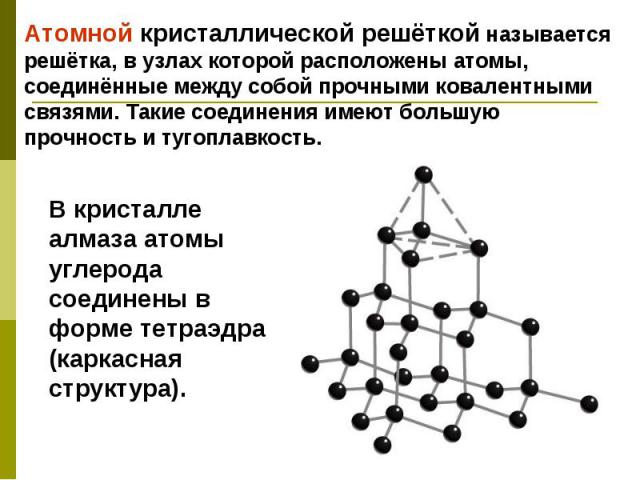
Типы кристаллических решеток Молекулярная В узлах находятся молекулы. Силы притяжения слабые. Вещества непрочные, легкоплавкие, летучие. Газы и жидкости в твердом состоянии, сера, иод, нафталин, белый фосфор, углекислый газ(«сухой лёд»), органические вещества




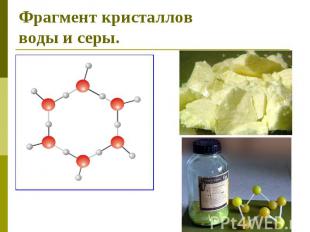
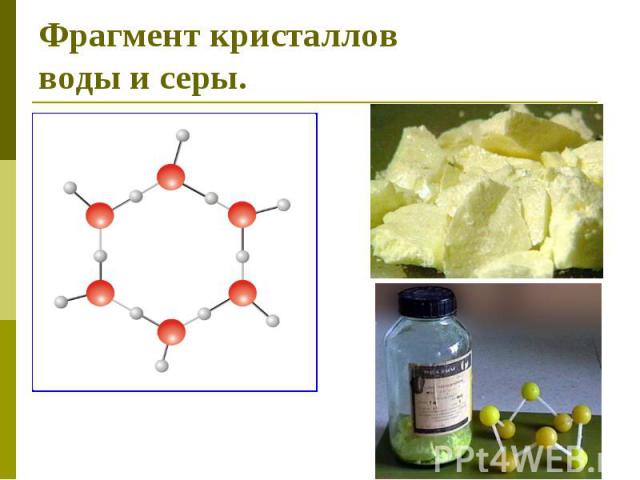
Фрагмент кристаллов воды и серы.

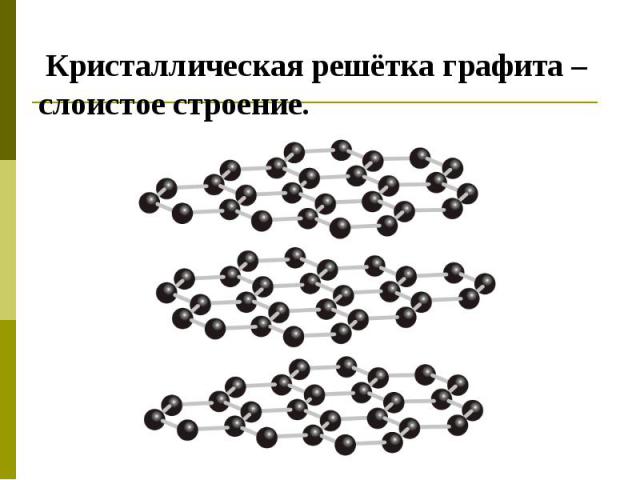
Кристаллическая решётка графита –слоистое строение.

Графит.

Домашнее задание Габриелян химия 11 базовый уровень § 4 стр.37 вопросы 1. 2, 3,6, 7,8 Габриелян , Лысова Химия 11 § 6 стр. 46 – 51 стр. 56 вопросы 3,4,5 Составьте формулу ионного фторида и молекулярного оксида с наименьшей молекулярной массой. Рассчитайте массовые доли фтора и кислорода в этих соединениях