Презентация на тему: Коррозия металлов






Исследовать действие факторов окружающей среды на степень ржавления металлов. Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии уменьшится.

1. Изучить сущность коррозии, её виды и способы защиты от коррозии. 1. Изучить сущность коррозии, её виды и способы защиты от коррозии. 2.Исследовать зависимость скорости коррозии от присутствия кислорода. 3.Исследовать влияние электролитов на процесс коррозии. 4.Исследовать влияние ингибиторов на процесс коррозии.

1. Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. 1. Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. 2.Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения. 3.Отрицательно влияет на жизнь и здоровье людей.

Коррозия — гетерогенный процесс который происходит на границе раздела фаз «металл — окружающая среда». В результате коррозии металлы окисляются и переходят в устойчивые соединения — оксиды или соли, в виде которых они и находятся в природе.

В случае химической коррозии происходит взаимодействие металла непосредственно с окислителем окружающей среды. В результате этого разрушается металлическая связь, и атомы металла соединяются с атомами и группами атомов, входящих в состав окислителей. В случае химической коррозии происходит взаимодействие металла непосредственно с окислителем окружающей среды. В результате этого разрушается металлическая связь, и атомы металла соединяются с атомами и группами атомов, входящих в состав окислителей. 2Fe0+3Cl20→-2Fe+3Cl3 3Fe+2O2→Fe3O4

Этот вид коррозии встречается наиболее часто и представляет собой процесс взаимодействия металлов и сплавов с электролитами, сопровождающийся самопроизвольным возникновением гальванических пар «катод - анод». Этот вид коррозии встречается наиболее часто и представляет собой процесс взаимодействия металлов и сплавов с электролитами, сопровождающийся самопроизвольным возникновением гальванических пар «катод - анод». Анод на железе(+) Катод на меди(-) Fe 0-2e=Fe2+ 2H++2e=2H0 →H20

1. Кислород и влага атмосферы 1. Кислород и влага атмосферы 2. Углекислый и сернистый газы, содержащие в атмосфере 3. Морская вода 4. Грунтовые воды

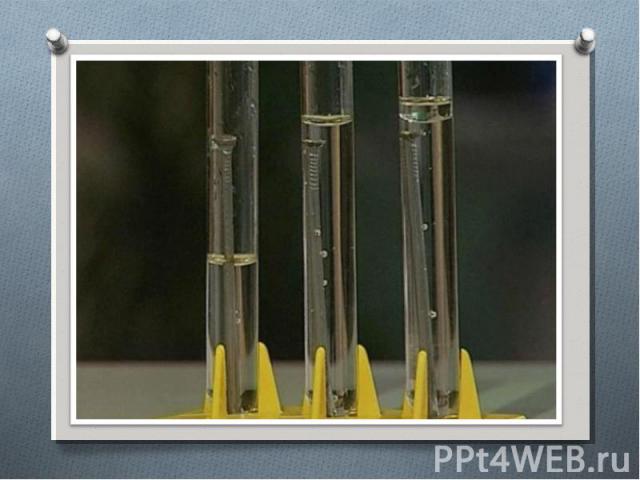
Эксперимент №1. Роль кислорода в процессе коррозии железа. Эксперимент №1. Роль кислорода в процессе коррозии железа. В пробирке №1-ж. гвоздь+вода на половину. В пробирке №2-ж. гвоздь+вода полностью. В пробирке №3-ж. гвозды-вода+масло.



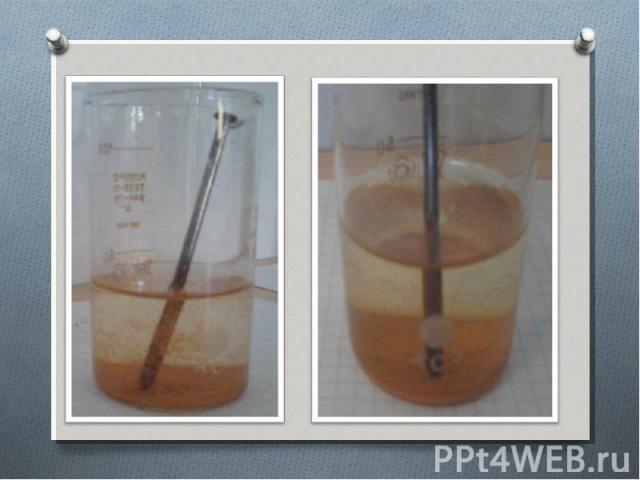
Эксперимент№2. Эксперимент№2. Влияние электролитов на процесс коррозии. В стакане №1-ж. гвоздь + вода. В стакане №2-ж. гвоздь + раствор хлорида натрия. В стакане №3-ж. гвоздь + медь + раствор хлорида натрия. В стакане №4-ж. гвоздь + алюминий + раствор хлорида натрия.
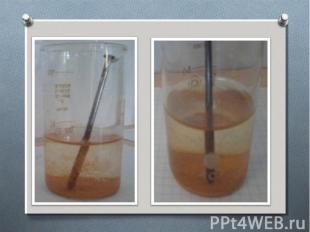


Эксперимент №3. Эксперимент №3. Влияние ингибиторов на процесс коррозии. В пробирке №1 - ж. гвоздь + раствор гидроксида натрия. В пробирке №2 - ж. гвоздь + раствор фосфата натрия. В пробирке №3 - ж. гвоздь + раствор дихромата натрия.


1.Коррозия железа резко усиливается в присутствии кислорода. 1.Коррозия железа резко усиливается в присутствии кислорода. 2.Коррозия железа резко усиливается, если он соприкасается с менее активным металлом, но коррозия замедляется, если железо соприкасается с более активным металлом. 3. Скорость коррозии зависит от состава омывающей металл среды. Хлорид ионы усиливают коррозию железа. 4. Коррозия железа ослабляется в присутствии гидроксид - ионов, фосфат - ионов и хромат - ионов.

1. Изменение состава технического металла. 1. Изменение состава технического металла. 2. Защитные покрытия. 3. Изменение состава среды. 4. Электрохимические методы. 5. Конструктивные меры.


Выдвинутая гипотеза подтвердилась, коррозия в щелочной среде уменьшается. Выдвинутая гипотеза подтвердилась, коррозия в щелочной среде уменьшается. Таким образом, известно и используется на практике множество способов защиты металлов от коррозии. Однако они полностью не защищают металлы от разрушения, поэтому учёные заняты поиском новых, более перспективных способов защиты.

Спасибо за внимание Спасибо за внимание