Презентация на тему: Классификация химических элементов

Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.

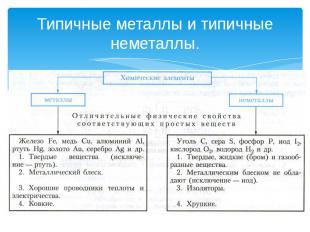
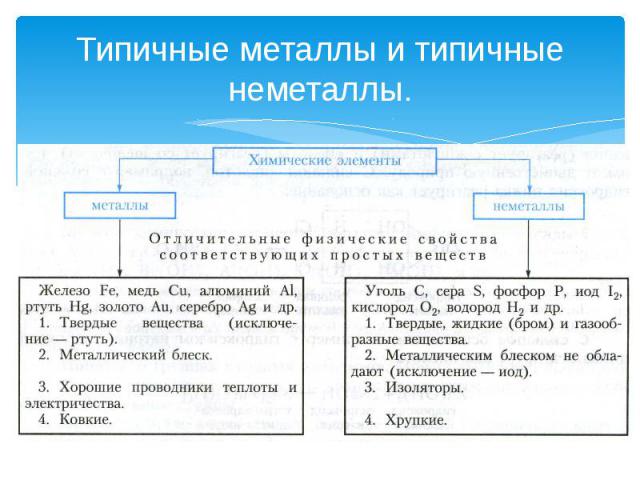
Типичные металлы и типичные неметаллы.

Типичный металл взаимодействует с кислородоми образует основный оксид:Na2O, MgO, CaO, BaO, K2O.2Ca + O2 = 2CaO оксид кальциякоторому соответствует основаниеСaO + H2O = Ca(OH)2 гидроксид кальция Основание реагирует с кислотой, образуя соль и воду:Ca(OH)2 + 2HCl = CaCl2 + 2H2O хлорид кальцияМеталл вытесняет из кислот водород:Mg + H2SO4 = MgSO4 + H2↑. сульфат магнияТипичный неметаллвзаимодействует с кислородоми образует кислотный оксид:CO2, SO2, P2O5, SiO2, SO3.4P + 5O2 = 2P2O5Которому соответствует кислотаP2O5 + 3H2O = 2H3PO4Кислота реагирует с основанием,Образуя соль и воду:H3PO4 + 3NaOH = Na3PO4 + 3H2OНеметалл с кислотой не реагирует. Неметалл реагирует с водородом и образует летучее водородное соединение:S + H2 = H2S.

Найди соответствие, для этого выбери каждому номеру букву верного утверждения:

Верный ответ: 1- Б, В, Ж.2 – А, Д.3 – А, Б, Г, Ж.4 - Е

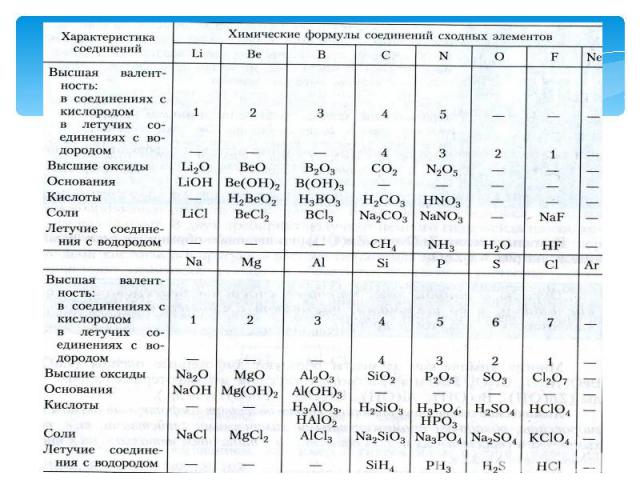
Классификация химических элементов на металлы и неметаллы оказалась неполной Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства.Амфотерными называют оксиды и гидроксиды, которые взаимодействуют и с кислотами и со щелочами, образуя соль и воду: ZnO – Zn(OH)2, Al2O3 – Al(OH)3, Cr2O3 – Cr(OH)3, BeO – Be(OH)2, PbO – Pb(OH)2.

1.Амфотерные свойства оксида и гидроксида цинка. Оксид цинка взаимодействует с кислотами образуя соль и воду:ZnO + H2SO4 = ZnSO4, следовательно, оксид цинка проявляет свойства основного оксида.Гидроксид цинка тоже реагирует с кислотой, образуя соль и воду:Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, т.е. проявляет свойства основания.

2.Амфотерные свойства оксида и гидроксида цинка Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH = Na2ZnO2 + H2O оксид цинка проявляет свойства кислотного оксида H2ZnO2 цинкат натрия Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O гидроксид цинка проявляет свойства кислоты Эти реакции протекают при сплавлении твердых веществ.

Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 + 3H2O Al(OH)3 + 3HCl = AlCl3 + 3H2O Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O
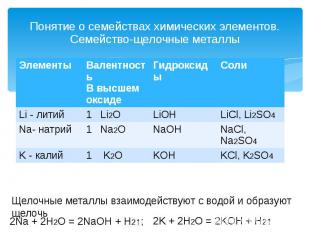
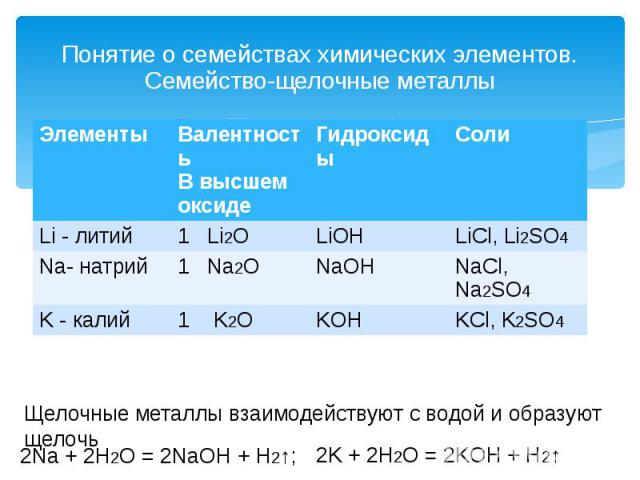
Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na + 2H2O = 2NaOH + H2↑; 2K + 2H2O = 2KOH + H2↑

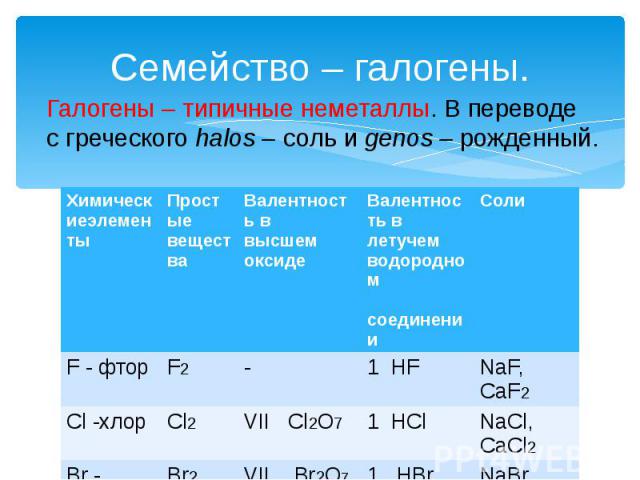
Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos – рожденный.

Открытие периодического закона Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и другие – предлагали различные варианты классификации химических элементов.Только открытие русским ученым Д. И. Менделеевым одного из фундаментальных законов природы – периодического закона химических элементов – позволило создать единую систему химических элементов.
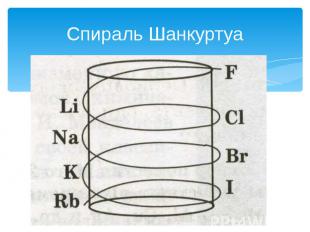
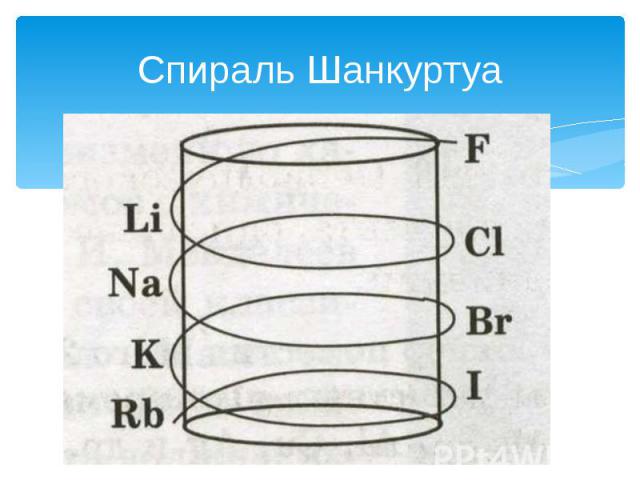
Спираль Шанкуртуа

Закон октав Дж. Ньюлендса

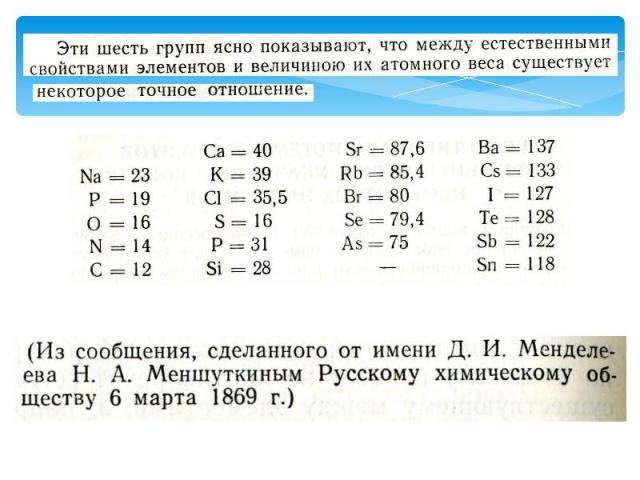
Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых им веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Пример триады: Li, Na, К.Ar(Na) = (7 + 39): 2 - 23.Примерами других триад могут служить:S, Se, Те;CI, Br, I.

Таблица химических элементов Л. Мейера


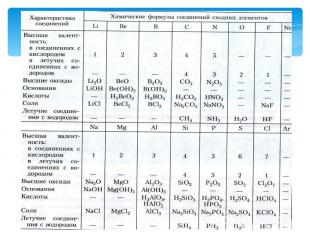

В основу периодического закона Д. И. Менделеев взял коренное свойство химического элемента- его атомный вес. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si, P, S, Cl) и обрываются у инертного газа (Ar);2)валентность в высших оксидах возрастает от 1-го до 7-и;3)валентность в летучих водородных соединениях уменьшается от 4-х до 1-го;4)свойства химических элементов повторяются периодически (через 7 на 8-ой).

Д. И. Менделеев сформулировал периодический закон так: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов

Возникают вопросы: Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически?Почему в некоторых случаях (Ar –K, Co-Ni, Te-I) расположены не по возрастанию Ar?Д. И. Менделеев предполагал, что вопросы будут решены при выявлении сложной структуры атома.

!Спасибо за сотрудничество!