Презентация на тему: Биогенные S–элементы

БИОГЕННЫЕ S–ЭЛЕМЕНТЫ s-Элементы – это элементы, в атомах которых заполняется электронами s-подуровень внешнего электронного уровня. К ним относятся 14 элементов: Н, Не и 12 металлов.

+2 +1 Степень окисления Me -2e Me+2 Me -1e Me+1 Схема окисления при химических взаимодействиях ns2 ns1 Электронное строение внешнего уровня Вe, Mg, Ca, Sr, Вa, Ra Li, Na, K, Rb, Cs, Fr s-Элементы - металлы IIA IA Группа Характеристика Общая характеристика

2Na+Cl2=2NaCl хлорид натрия 2Na+S=Na2S сульфид натрия 2Na+H2=2NaH гидрид натрия 2Na+2H2O=2NaOH+H2 гидроксид натрия, водорастворимое основание, щелочь 2Na+O2=Na2O2 пероксид натрия Натрий, химические свойства Электронная формула: 11Na 1s22s22p63s1; c.o.+1, комплексообразование не характерно.

Натрий, химические свойства Для регенерации воздуха в замкнутых помещениях используется реакция: 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+Na=2Na2O оксид натрия, основный оксид Na2O+H2O=2NaOH NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O сульфат натрия NaOH+CO2=NaHCO3 гидрокарбонат натрия, кислая соль, “питьевая сода”

Топография (Na) в организме=0,08%, макроэлемент, при массе тела 70 кг масса натрия 60г. Топография натрия: Na+- основной внеклеточный ион, распространен по всему организму, содержится в сыворотке крови, спинномозговой жидкости, в глазной жидкости, в пищеварительных соках, желчи, почках, коже, костной ткани, легких, мозге в виде растворимых солей NaCl, NaH2PO4, Na2HPO4, NaHCO3.

Биороль натрия: 1. Поддерживает постоянное осмотическое давление в 7,7 атм. (осмотический гомеостаз). 2. Поддерживает постоянное значение pH биожидкостей (кислотно-основный гомеостаз), т.к. входит в состав фосфатной и гидрокарбонатной буферных систем. 3. Участвует в регуляции водного обмена: 1г NaCl связывает 100мл воды. 4. Активирует ферменты. 5. Вместе с ионами K+, Ca2+, Mg2+, Cl- участвует в передаче нервных импульсов через мембраны нервных клеток, поддерживает нормальную возбудимость мышечных клеток. 6. NaCl -основной источник желудочного сока: H2CO3+ Cl-= HCO3- + HCl кровь NaCl кровь желудок 7. Ионы Na+ транспортируют CO2, сахара, аминокислоты через мембраны. 8. Ионы Na+ и K+ участвуют в механизме кратковременной памяти.

Избыток и дефицит Na: Избыток Na+ в клетках головного мозга угнетает ЦНС, вызывает депрессию. Недостаток Na+ ведёт к отёку клеток головного мозга, судорогам, торможению развития организма. Суточная потребность –1г. В организм Na+ поступает в виде NaCl, избыток NaCl приводит к развитию гипертонии, атеросклерозу, нарушению деятельности почек. Недостаток губителен, т.к. Na+ участвует в проведении нервных импульсов.

Лекарственные препараты: 1. NaCl - 0,9%-ный раствор, физиологический раствор, изотонический раствор. Внутривенно при интоксикациях и обезвоживании, для промывания ран, для растворения лекарственных препаратов. 2. NaCl – 3-5-10%-ный раствор, гипертонический раствор. Наружно в компрессах для лечения гнойных ран. В результате осмоса происходит отделение гноя из раны и плазмолиз бактерий. При отравлении солями серебра: Ag++NaClAgCl+Na+ нерастворим, нетоксичен 3. NaHCO3-питьевая сода: а) 4%-й раствор внутривенно при ацидозе: NaHCO3+RCOOH=RCOONa+H2O+CO2 с мочой через легкие

Лекарственные препараты: б) при повышенной кислотности желудочного сока: NaHCO3+HCl=NaCl+H2O+CO2 в) слабый антисептик, т.к. в результате гидролиза растворы питьевой соды имеют щелочную реакцию среды: NaHCO3+H2OH2CO3+NaOH, а щелочи губительно действуют на микробные клетки, осаждая клеточные белки. 4. Na2SO4 - слабительное средство, сульфат натрия плохо всасывается в кишечнике осмотическое давление в кишечнике увеличивается, жидкость через стенки поступает в просвет кишечника, его содержимое разжижается и выводится.

(К) в организме=0,23%, макроэлемент, масса калия в организме 160г. К+ - основной внутриклеточный катион, 98% калия содержится во внутриклеточных жидкостях. Топография: калий распространен по всему организму, находится во всех органах и тканях. Калий Электронная формула: 19К 1s22s22p63s23p64s1, с.о.=+1, комплексообразование не характерно.

Биороль К: Участвует в сокращении мышц, способствует мышечному расслаблению. Участвует в проведении нервных импульсов (совместно с Na+, Ca2+, Mg2+, Cl-). Поддерживает нормальное функционирование сердца: уменьшает силу сокращения сердечной мышцы (антагонизм с Са2+). Участвует в обменных процессах как активатор внутриклеточных ферментов в синтезе белка, окислении углеводов. В эритроцитах ионы K+ участвуют в работе гемоглобиновой и оксигемоглобиновой буферных систем.

Избыток и недостаток: Избыток K+ ведет к снижению содержания Na+, внеклеточная среда становится гипотонической и происходит гемолиз эритроцитов. Также избыток K+ угнетает сокращения миокарда. При повышенном содержании К+ в клетках коры головного мозга происходит возбуждение ЦНС, возникает маниакальное состояние. Недостаток K+ ведёт к аритмии, мышечной слабости, утомляемости. Калий содержится в сухом молоке, растительной пище: картофеле, моркови, орехах, клюкве, чае, семечках, сухофруктах. Суточная потребность 2-3 г.
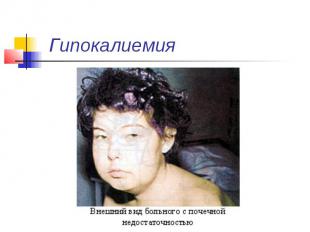
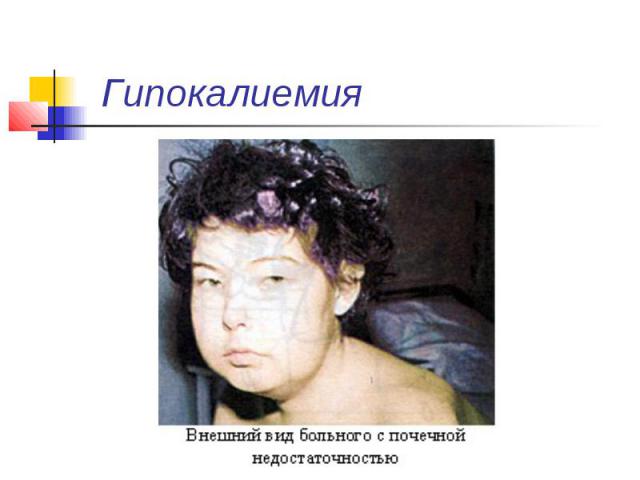
Гипокалиемия

Лекарственные препараты: KCl – при гипокалиемии, аритмии, рвоте. KI – при эндемическом зобе. KMnO4 – сильный окислитель, антисептик, наружно для промывания ран. KВr – при неврастении, неврозах, бессоннице.

Кальций Электронная формула: 20Ca 1s22s22p63s23p64s2, с.о.=+2, координационное число в комплексных соединений 6,7,8. Кальций образует несимметричные комплексы с различными биолигандами, может служить «мостиком» в межклеточном пространстве.

Химические свойства: Ca+S=CaS сульфид кальция Ca+Cl2=CaCl2 хлорид кальция 3Ca+N2=Ca3N2 нитрид кальция Ca+H2=CaH2 гидрид кальция Ca+2H2O=Ca(OH)2+H2 гидроксид кальция, основание 2Ca+O2=2CaO оксид кальция, основный оксид

Химические свойства: CaO+CO2=CaCO3 карбонат кальция, мел CaO+H2O=Ca(OH)2 Ca(OH)2+2CO2=Ca(HCO3)2 гидрокарбонат кальция Ca(HCO3)2CaCO3+H2O+CO2 Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2+H2SO4=CaSO4+2H2O сульфат кальция

Са in vivo ω (Ca) в организме = 1, 4%, макроэлемент, масса кальция ~ 1,5 кг. Топография: костная и зубная ткань: сердце, кровь, почки, печень. Ca2+ - внеклеточный ион.

Биороль кальция: 1. Является основным минеральным компонентом костной и зубной ткани в виде гидроксил- и фторапатитов (3Ca3(PO4)2 . Ca(OH)2 и 3Ca3(PO4)2 . CaF2). 2. Регулирует работу сердца: увеличивает силу сокращения сердечной мышцы. 3. Участвует в свёртываемости крови, способствует агрегации тромбоцитов. 4. Участвует в сокращении мышц и передаче нервных импульсов. 5. Ионы Ca2+ понижают возбудимость ЦНС. 6. Обладает противовоспалительным и антиаллергическим действием.

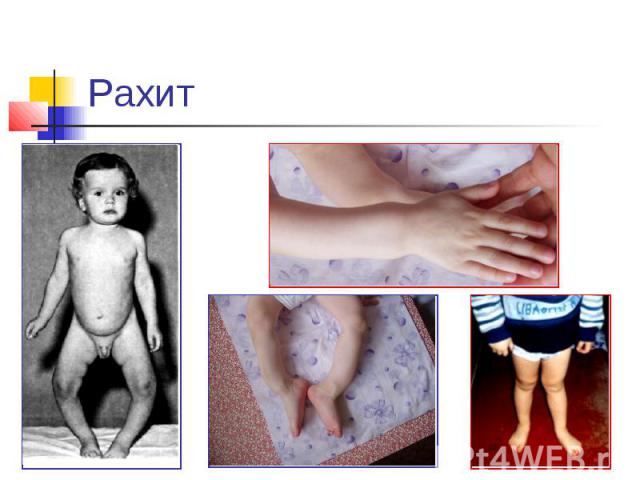
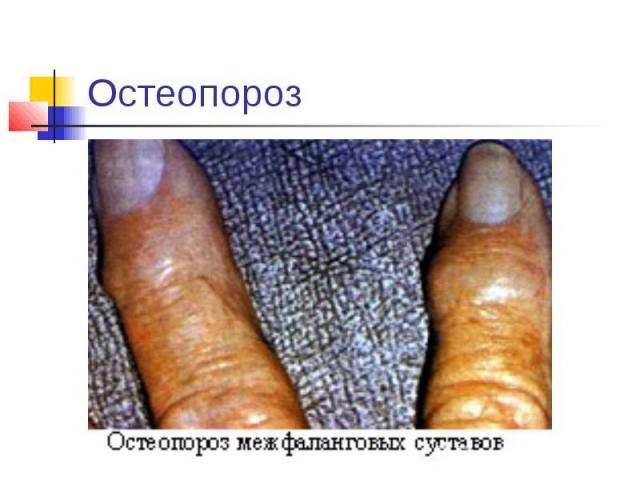
Избыток и недостаток: Суточная потребность ~ 1г. При недостатке Ca2+ : снижение свертываемости крови, судороги, конвульсии, рахит у детей (не окостенение хрящей), остеомаляция (размягчение костей), остеопороз (изрешечивание костей). При избытке Ca2+: отложение солей (артриты, тромбозы, глаукома, известкование сосудов). Кальций содержится в молоке, сыре, твороге и других молочных продуктах, свежих овощах.

Дефицит кальция. Тонические судороги мышц кисти руки.
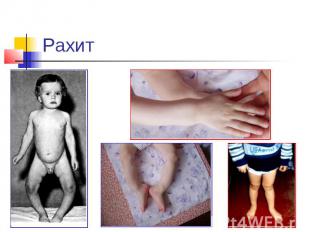
Рахит
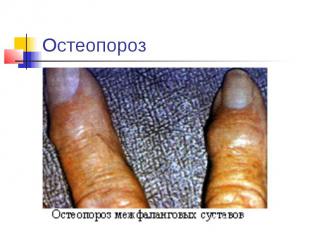
Остеопороз

Артроз

Лекарственные препараты кальция: 1. CaCO3 – мел осажденный, антацидное средство, применяется для уменьшения кислотности желудочного сока: CaCO3+2HCl=CaCl2+CO2+H2O 2. CaCl2.6H2O - кальций хлористый, применяют как противовоспалительное и антиаллергическое средство, для снятия сердечно-сосудистого спазма, для улучшения свертывания крови, при переломах костей и при ревматизме. 3. 2CaSO4.H2O - гипс, широко используется в травматологической и стоматологической практике, т.к. при замешивании его с водой образуется нерастворимый CaSO4.2H2O: 2CaSO4.H2O+3H2O=2(CaSO4.2H2O) В результате происходит быстрое затвердение с некоторым увеличением объема, что используется для фиксации при переломах костей и получения хороших слепков в стоматологии.

Магний Электронная формула: 12Mg 1s22s22p63s2, с.о.=+2, координационное число 6, магний образует комплексы с биолигандами, в составе которых есть донорные атомы азота, поэтому магний – незаменимый компонент и активатор ферментов ( входит в состав хлорофилла, холинэстеразы и др.).

Биороль магния: 1. Регулирует артериальное давление. 2. Уменьшает спазм сосудов. 3. Регулирует работу сердца ( при недостатке магния – склонность к инфарктам). 4. Участвует в обмене энергии, т.к. гидролиз АТФ происходит при обязательном участии магния: [АТФ Мg]2– +H2O→ [АДФ Мg]– +H2PO4- + ∆H 5. Является строительным материалом костей и зубов: Mg3(PO4)2 и Mg(OH)2 . 4MgCO3 . H2O 6. Как комплексообразователь, входит в состав ферментов, катализирующих более 300 биохимических реакций (синтез нуклеиновых кислот, белков в рибосомах, гликолиз, гидролиз ацетилхолина в печени и др.). 7. Влияет на работу ЖКТ, является желчегонным, снижает уровень холестерина.

Mg in vivo (Mg)в организме=0,027%, макроэлемент, масса магния в организме 20г. Топография: дентин и эмаль зубов, костная ткань, поджелудочная железа, скелетные мышцы, почки, печень, сердце.Mg2+ - внутриклеточный ион.

Избыток и недостаток Mg: В организм поступает с пищей: рыба, морская капуста, соя, какао, грецкие орехи, фасоль, овсяные хлопья, жёсткая вода. Недостаток Mg2+ вызывает повышенную возбудимость ЦНС, судороги, плаксивое настроение, выпадение волос. Избыток Mg2+ вызывает потерю чувствительности, сонливость, наркоз.

Лекарственные препараты: MgO - жженая магнезия, антацидное средство без побочного действия: MgO+2HCl=MgCl2+H2O. MgO+MgO2 – «магний перекись», при желудочно-кишечных расстройствах, обладает антацидным и бактерицидным действием: MgO+MgO2+4HCl=2MgCl2+H2O+H2O2. MgSO4 – сульфат магния: а) слабительное средство; б) гипотензивное средство, 10%-ный раствор (магнезия) внутривенно при гипертонических кризах. 2MgSiO3 . Mg(HSiO3)2 - тальк, в составе присыпок, мазей. Mg(OH)2.4MgCO3.H2O – белая магнезия, антацидное, легкое слабительное.

Спасибо за внимание. Учите, учите и учите…