Презентация на тему: Химические свойства бензола. Получение, применение

Химические свойства бензола. Получение, применение Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
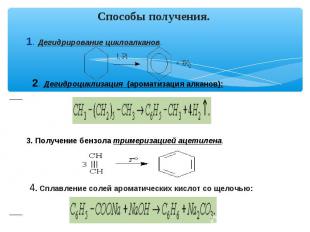
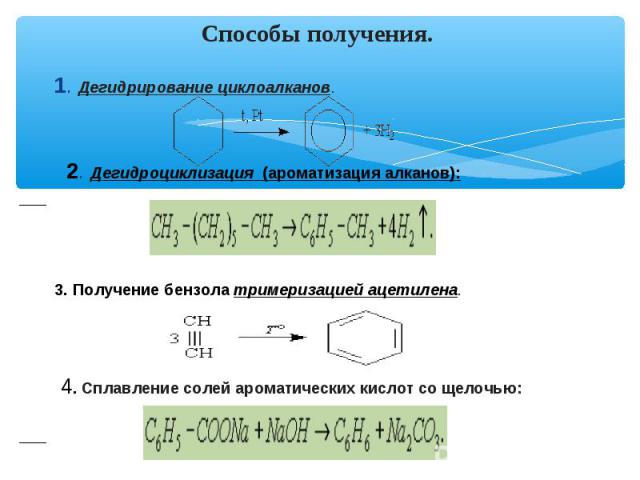
Способы получения. 1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических кислот со щелочью:

Химические свойства Обладая подвижной шестеркой p -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение p -электронного облака с двух сторон плоского s -скелета молекулы. Электрофильное замещение (SE) – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. Примеры электрофильных частиц: Cl+, NO2+, CH3+.
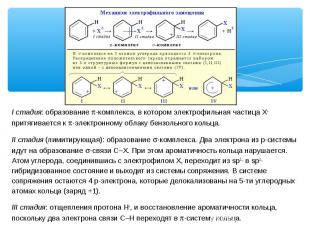
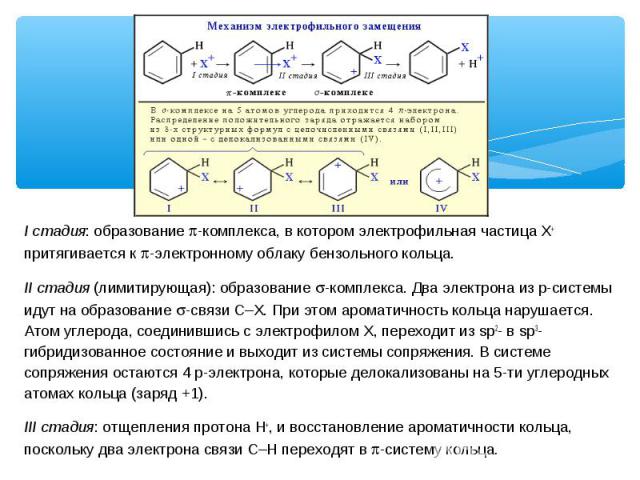
I стадия: образование p-комплекса, в котором электрофильная частица Х+ притягивается к p-электронному облаку бензольного кольца. II стадия (лимитирующая): образование s-комплекса. Два электрона из p-системы идут на образование s-связи С–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2- в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 p-электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1). III стадия: отщепления протона Н+, и восстановление ароматичности кольца, поскольку два электрона связи С–Н переходят в p-систему кольца.

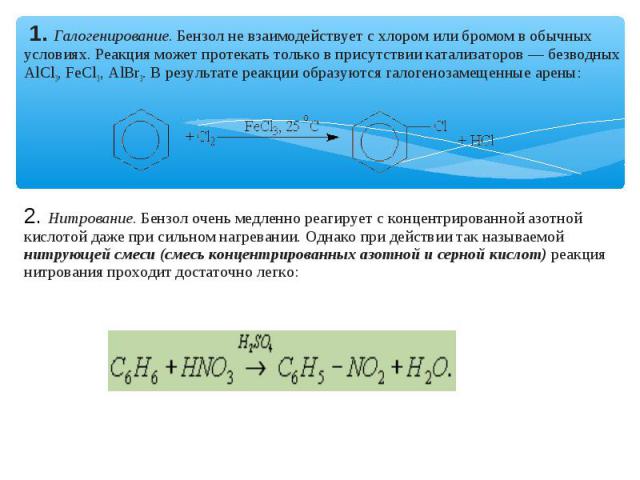
1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены: 2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:

3. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы: В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:

4.Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:

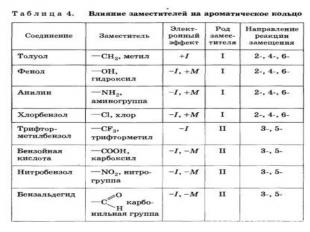
Правила ориентации (замещения) в бензольном кольце. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. В молекулах, имеющих только s -связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта. Влияние заместителей, передающееся по сопряженной системе p -связей, называется мезомерным (М) эффектом. В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.

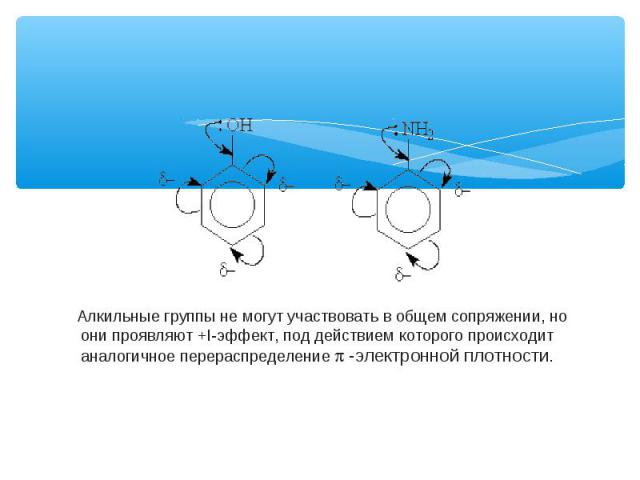
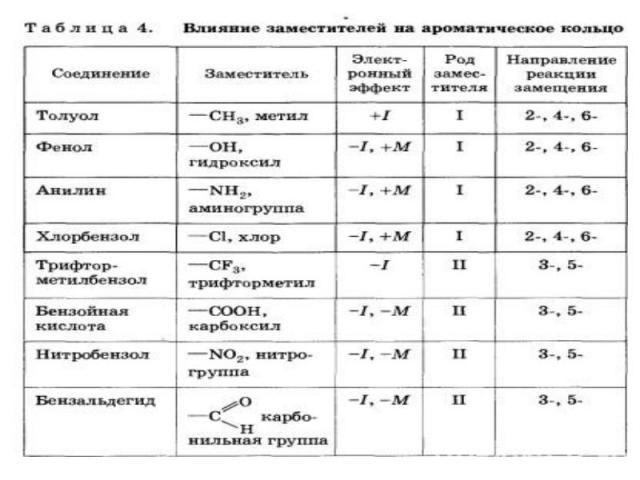
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): 1.электронодонорные 2.электроноакцепторные. Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
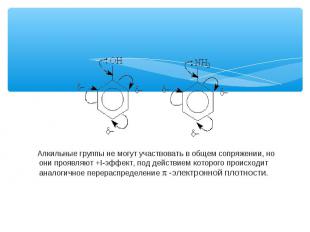
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
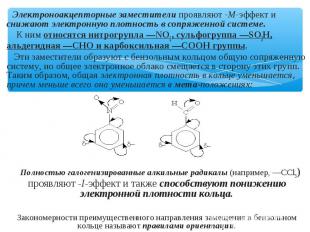
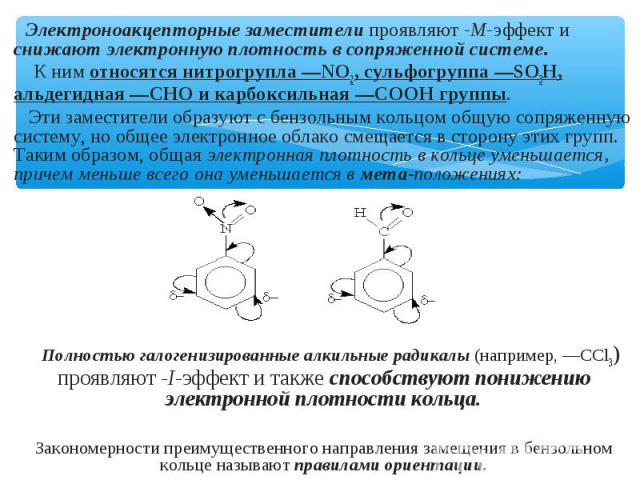
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях: Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца. Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.

Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называются заместителями (ориентантами) первого рода: Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
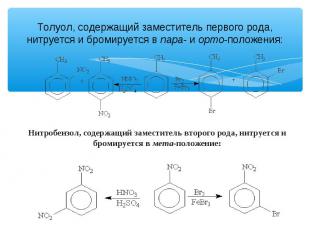
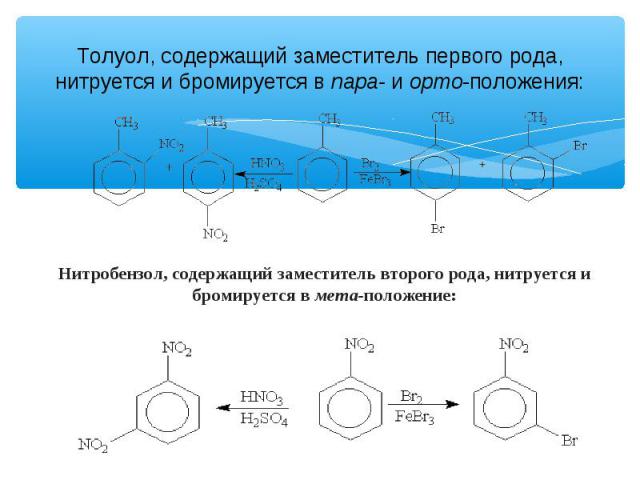
Толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения: Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:

Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях. 1. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:
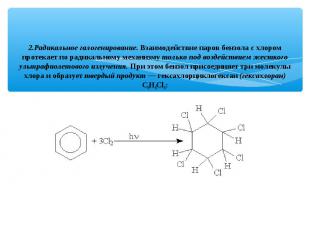
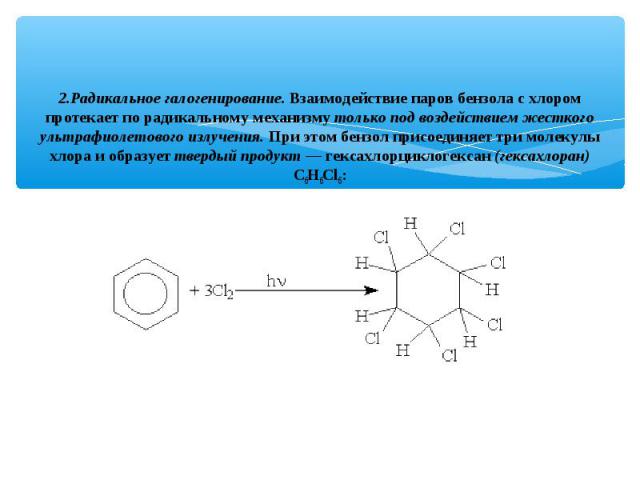
2.Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:

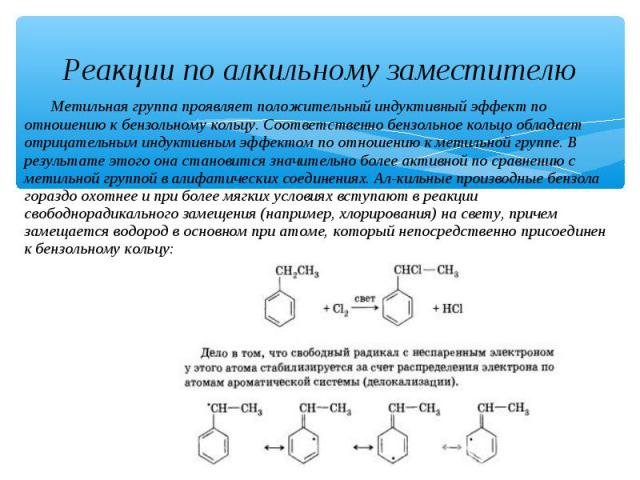
Реакции по алкильному заместителю Метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным индуктивным эффектом по отношению к метильной группе. В результате этого она становится значительно более активной по сравнению с метильной группой в алифатических соединениях. Ал-кильные производные бензола гораздо охотнее и при более мягких условиях вступают в реакции свободнорадикального замещения (например, хлорирования) на свету, причем замещается водород в основном при атоме, который непосредственно присоединен к бензольному кольцу:
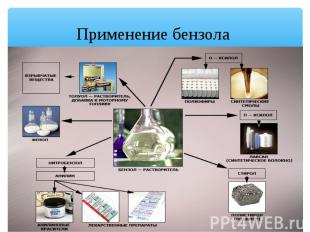
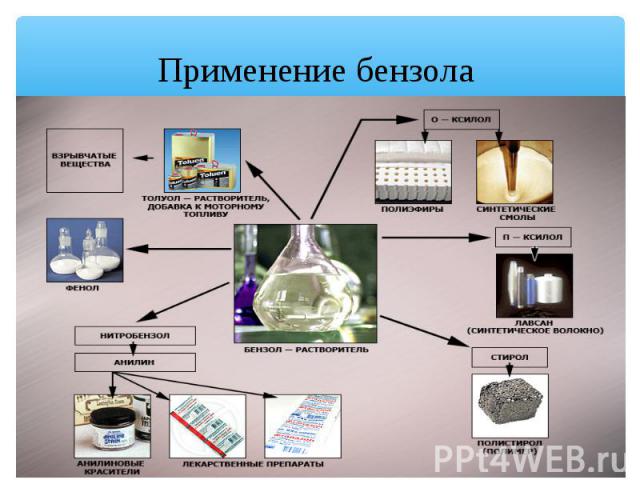
Применение бензола