Презентация на тему: Качественная реакция на II аналитическую группу

Лабораторная работа №2 Качественная реакция на II аналитическую группу Подготовили: Короткова К.; Зинченко В.; Гарькавая А. Студенты группы 29фм4 Преподаватель: Петракова Е. А. 2015 г. http://linda6035.ucoz.ru/

Опыт 1. Действие группового реагента На 2 предметные стекла поместили по 2 капли растворов солей серебра и свинца. http://linda6035.ucoz.ru/

Прибавили раствор соляной кислоты (1-2 капли). Наблюдали – выпадение осадков белого цвета. Ag+ + Cl- = AgCl↓ Pb2+ + 2Cl- = PbCl2↓ http://linda6035.ucoz.ru/

Опыт 2. качественная реакция на катионы СЕРЕБРА С раствором калия иодида. На предметное стекло поместили 1- 2 капли раствора соли нитрата серебра и добавили 1 каплю раствора калия иодида. Наблюдали – жёлтый осадок. AgNO3+ KI = AgI↓ + KNO3 http://linda6035.ucoz.ru/

С раствором натрия тиосульфата. На предметное стекло поместили 2 капли раствора нитрата серебра, прибавили 2 капли раствора тиосульфата натрия. Наблюдали – образование белого осадка, переходящего в желтый, затем – в черный. 2AgNO3+Na2S2O3= Ag2S2O3↓ +2NaNO3 Ag2S2O3=Ag2SO3+S↓ Ag2SO3+S↓+H2O= Ag2S↓+H2SO4 http://linda6035.ucoz.ru/

С формальдегидом в аммиачной среде (реакция «серебряного зеркала»). В хорошо промытую пробирку прибавили 3 - 4 капель раствора соли серебра и 3-4 капель раствор аммиака, добавили 3-4 капель формальдегида и нагрели. Наблюдали белый осадок. HCOH+2AgNO3+3NH4OH=2Ag↓+HCOONH4+ 2H2O+ 2NH4NO3 http://linda6035.ucoz.ru/

Действие карбоната натрия. При действии Na2CO3, на раствор соли серебра образовался AgCO3. Наблюдали жёлтый цвет, на воздухе буреет. http://linda6035.ucoz.ru/

Действие хромата калия. Фильтровальную бумагу смочили раствором K2CrO4. http://linda6035.ucoz.ru/

Нанесли каплю раствора соли серебра. Пятно окрасилось в фиолетовый цвет. K2CrO4 + AgNO3 -> K2NO3 + AgCrO4 http://linda6035.ucoz.ru/

Опыт 3. качественная реакция на катионы СВИНЦА С раствором калия иодида (реакция « золотой струи») В пробирку поместили по 3-4 капли раствора соли свинца (II) и раствора иодида калия. К полученному осадку прилили 3-4 капли очищенной воды и 3-4 капли разведенной уксусной кислоты, нагрели до растворения осадка, вылили полученный раствор в холодную воду. Наблюдали движение «золотой струи» при взбалтывании. Pb(NO3)2+ 2KI=PbI2↓+2KNO3 http://linda6035.ucoz.ru/

С раствором калия хромата. На предметное стекло поместили 2 капли соли свинца раствора и 2 капли раствора хромата калия. Наблюдали – образование желтого осадка. Pb(NO3)2+K2CrO4= PbCrO4↓ + 2KNO3 http://linda6035.ucoz.ru/

Действие гидроокисей натрия. В две пробирки налили по несколько капель соли свинца. В одну пробирку прибавили такой же объём раствора NaOH, а в другую NH4OH. Наблюдали – в первой пробирки обесцвечивание, а в другой пробирки образование белого осадка. Pb(NO3)2 + 2NaOH=Pb(OH)2↓ + 2NaNO3 Pb(NO3)2 + NH4OH=PbOH+NH4(NO3)2 http://linda6035.ucoz.ru/

Действие с серной кислотой. При действии серной кислоты на соли свинца образовался PbSO4 – очень мало растворимая соль. http://linda6035.ucoz.ru/

Опыт 4. Анализ катионов ртути Действие гидроокисей натрия. При действии едкого щелоча NaOH на ртуть (I) образовался чёрный осадок Hg2O, растворяющийся в HNO3. Hg2(NO3)2 + 2NaOH => Hg2O + Н2O+2NaNO3 Действие щелочей на ртуть (II) вызывал выпадение оранжевого (жёлтого) осадка HgO, растворяющийся в разбавленных кислотах. Hg(NO3)2 + 2NaOH => HgO + H2O + 2NaNO3. http://linda6035.ucoz.ru/

Гидроксид аммония с ртутью (I) дал осадок амидосоединения и металлической ртути (чёрный цвет осадка обусловлен выделением металлической ртути): Hg2Cl2+2NH4OH=NH2HCl↓ +Hg↓ +NH4Cl+2H2O Осадок нерастворим в избытке реактива. При взаимодействии аммиака с ртутью (II) образовался белый осадок амидосоединения, растворяющийся в избытке реактива: HgCl2+2NH4OH=NH2HgCl↓+NH4Cl+2H2O http://linda6035.ucoz.ru/

Действие иодида калия. Иодид калия с ртутью (II) образовал красный осадок HgJ2: Hg(NO3)2+2KJ=HgJ2+2KNO3. В избытке реактива происходило образование комплексной соли K2[HgJ4], при этом раствор обесцветился. Иодид калия с ртутью (I) дал жёлтый осадок Hg2J2. Hg2J2+2KJ=K2[HgJ4]+Hg↓. http://linda6035.ucoz.ru/

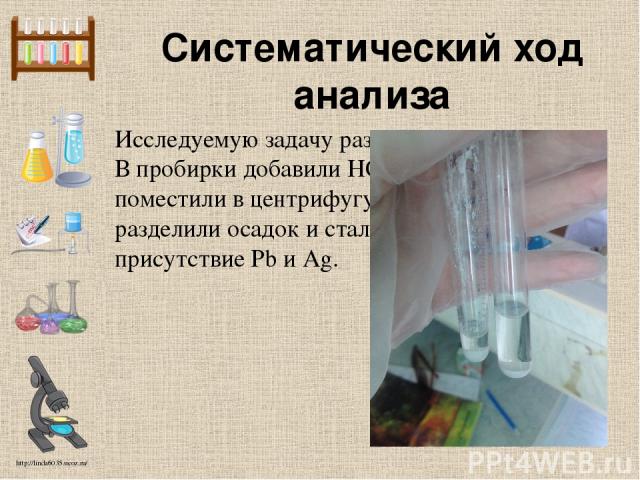
Систематический ход анализа Исследуемую задачу разделяли на 2 пробирки. В пробирки добавили HCl 2n. После чего поместили в центрифугу на 3 минуты, разделили осадок и стали проверять на присутствие Pb и Ag. http://linda6035.ucoz.ru/

В пробирку с центрифугатом добавили 2-3 капли аммиака. После поместили 1-2 капли исследуемого раствора на предметное стекло и потерли палочкой и выявили в нашей задаче присутствие Pb и Ag. Наблюдали белые кристаллы. http://linda6035.ucoz.ru/

СПАСИБО ЗА ВНИМАНИЕ!!! http://linda6035.ucoz.ru/
















![Действие иодида калия. Иодид калия с ртутью (II) образовал красный осадок HgJ2: Hg(NO3)2+2KJ=HgJ2+2KNO3. В избытке реактива происходило образование комплексной соли K2[HgJ4], при этом раствор обесцветился. Иодид калия с ртутью (I) дал жёлтый осадок … Действие иодида калия. Иодид калия с ртутью (II) образовал красный осадок HgJ2: Hg(NO3)2+2KJ=HgJ2+2KNO3. В избытке реактива происходило образование комплексной соли K2[HgJ4], при этом раствор обесцветился. Иодид калия с ртутью (I) дал жёлтый осадок …](https://fs3.ppt4web.ru/images/159218/206772/640/img15.jpg)