Презентация на тему: Анализ катионов IV аналитической группы

Лабораторная работа № 4 Анализ катионов IV аналитической группы Выполнили: Короткова К. Гарькавая А. Зинченко В. 2015 г.

Анализ катионов IV аналитической группы Содержание Действие раствора гидроксида натрия Изучение свойств растворов Реакция восстановления Fe(III) до Fe(II) Реакция окисления Cr пероксидом водорода Реакция образования надхромовой кислоты Образование окрашенных перлов буры Действие K4[Fe(CN)6] Действие дитизона Действие р-ра натрия ацетата Действие кобальта нитрата Систематический ход анализа катионов IV аналитической группы

Опыт 1. Действие раствора гидроксида натрия К 3-4 каплям отдельно взятых растворов солей алюминия, цинка, олова(II), олова(IV), хрома приливали по 4 капли раствора натрия гидроксида. Поместили в две пробирки небольшое количество каждого из осадков и прилили в одну из пробирок избыток натрия гидроксида, в другую - раствор минеральной кислоты.

Опыт 1. Действие раствора гидроксида натрия При добавлении гидроксида натрия: 2NaOH + ZnCl2 → 2NaCl + Zn(OH)2↓(белый студенистый) AlCl3 + 3NaOH(разб.) → Al(OH)3↓ (белый студ.)+ 3NaCl 2NaOH + SnCl2 → 2NaCl + Sn(OH)2↓(бел. осадок) 6NaOH + Cr2(SO4)3 → 3Na2SO4 + 2Cr(OH)3↓(аморфн. осадок зел. цвета) При добавлении к осадкам изб. щелочи(наблюдали растворение осадков): Al(OH)3 + OH- → [Al(OH)4]- Cr(OH)3 + 3OH- → [Cr(OH)6]3- Zn(OH)2 + 2OH- → [Zn(OH)4]- Sn(OH)2 + 4OH- → [Sn (OH)6]4-

Опыт 1. Действие раствора гидроксида натрия При добавлении к осадком р-ра минеральной кислоты: Zn(OH)2+2HCl=ZnCl2(бел.осадок)+2H2O Al(OH)3+3HCl=AlCl3(бел. осадок)+3H2O Cr(OH)3+3HCl=CrCl3(зел. цвет)+3H2O Sn(OH)2+2HCl=SnCl2(прозрачный)+2H2O Sn(OH)4+4HCl=SnCl4+4H2O

Опыт 1. Действие раствора гидроксида натрия

Опыт 2. Изучение свойств растворов
![Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCL AlC Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCL AlC](https://fs3.ppt4web.ru/images/159218/206770/310/img7.jpg)
Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCL AlCl3 +2 Избыток NaOH = Na3[Al(OH)6] +HCL 2CrCl3 +6 Избыток NaOH =2 Na3[Cr(OH)6] + HCL SnCl2 + Избыток NaOH = Na2[Sn(OH)4] + 2НCl SnCl4+ Избыток NaOH = Na2[Sn(OH)6] +HCL При добавлении гидроксида натрия избытка образовывались гидроксокомплесы. При нагревании: Na3[Cr(OH)6] + 3СО2 = Cr(OH)3 + 3NaHCO3 2 Na3Al(OH)6+ 3 CO2 = 3 Na2CO3 + 2 Al(OH)3 + 3 H2O Так же и при нагревании образуются исходные гидроксиды (Na3[Cr(OH)6],Na2[Sn(OH)4] ,Na2[Sn(OH)6] ).
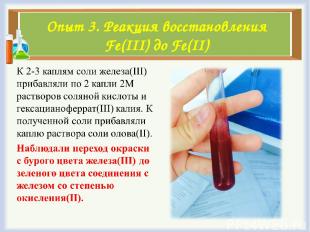
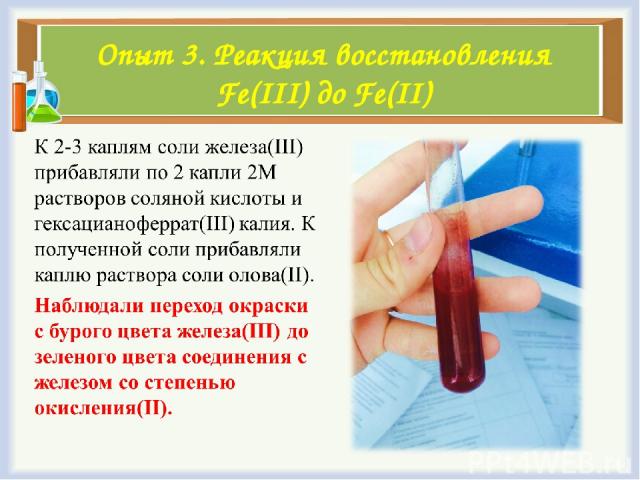
Опыт 3. Реакция восстановления Fe(III) до Fe(II)

Опыт 3. Реакция востановления Fe(III) до Fe(II)

Опыт 4. Реакция окисления Cr пероксидом водорода

Опыт 4. Реакция окисления Cr пероксидом водорода

Опыт 5. Реакция образования надхромовой кислоты

Опыт 5. Реакция образования надхромовой кислоты

Опыт 6. Образование окрашенных перлов буры Прокаливали ушко платиновой проволоки до красного цвета, дотрагивались им до твердого натрия тетрабората и прокаливали в пламени газовой горелки, пока масса не пересталп пениться. Охладили полученную стекловидную массу и,взяв немного осадка гидроксида хрома(III), снова прокалоли. После охлаждения отметили цвет перла в проходящем свете. 3Na2B4O7 + 2Cr(NO3)3 = 6NaBO2 + 2Cr(BO2)3 + 3N2O5
![Опыт 7. Действие K4[Fe(CN)6] Опыт 7. Действие K4[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206770/310/img15.jpg)
Опыт 7. Действие K4[Fe(CN)6]

Опыт 8. Действие дитизона

К 2-3 каплям раствора соли алюминия прибавляли 10 капель раствора аммиака и 2 капли раствора ализарина. При появлении фиолетовой окраски прибавляли по каплям уксусную кислоту до перехода фиолетовой окраски в красную. AlCl3+3NH4OH+C14H6O2(OH)2=Al(OH)2C14H6O2(OH)↓+3NH4Cl+H2O. Наблюдали образование ализаринового лака. Опыт 9. Действие ализарина

К 2-3 каплям раствора соли алюминия прибавляли 2 капли раствора натрия ацетата и нагревают на водяной бане. Наблюдаем образование хлопьевидного осадка AlCl3 + CH3COONa + H2O = Al(OH)(CH3COO)2 + CH3COOH + NaCl Опыт 10. Действие р-ра натрия ацетата

Опыт 11. Действие кобальта нитрата
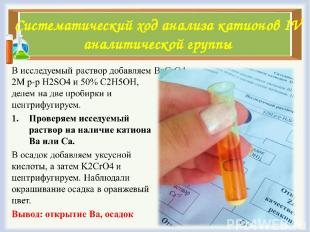
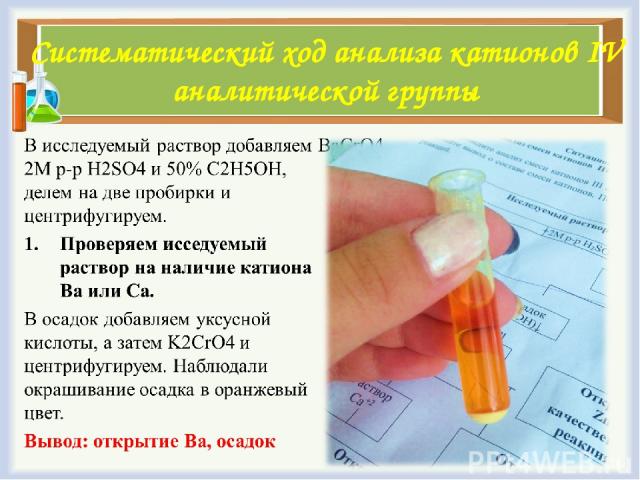
Систематический ход анализа катионов IV аналитической группы

Систематический ход анализа катионов IV аналитической группы

СПАСИБО ЗА ВНИМАНИЕ!!!








![Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCL AlCl3 +2 Избыток NaOH = Na3[Al(OH)6] +HCL 2CrCl3 +6 Избыток NaOH =2 Na3[Cr(OH)6] + HCL SnCl2 + Избыток NaOH = Na2[Sn(OH)4] + 2НCl SnCl4+ Избыток NaOH = Na2[Sn(OH)6] +HCL Пр… Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCL AlCl3 +2 Избыток NaOH = Na3[Al(OH)6] +HCL 2CrCl3 +6 Избыток NaOH =2 Na3[Cr(OH)6] + HCL SnCl2 + Избыток NaOH = Na2[Sn(OH)4] + 2НCl SnCl4+ Избыток NaOH = Na2[Sn(OH)6] +HCL Пр…](https://fs3.ppt4web.ru/images/159218/206770/640/img7.jpg)






![Опыт 7. Действие K4[Fe(CN)6] Опыт 7. Действие K4[Fe(CN)6]](https://fs3.ppt4web.ru/images/159218/206770/640/img15.jpg)