Презентация на тему: 1,2-ДИМЕТИЛБЕНЗОЛ


История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.

Второе рождение Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.

Новое получение В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)


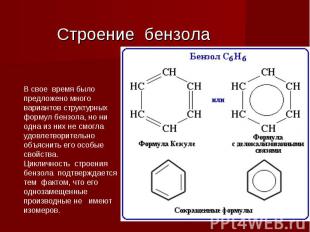
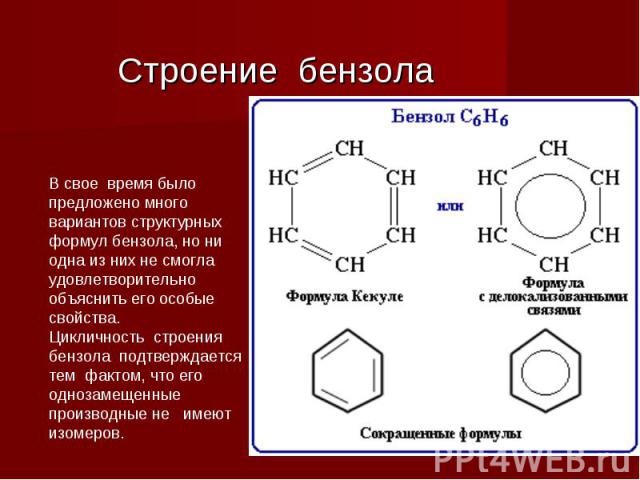
Строение бензола

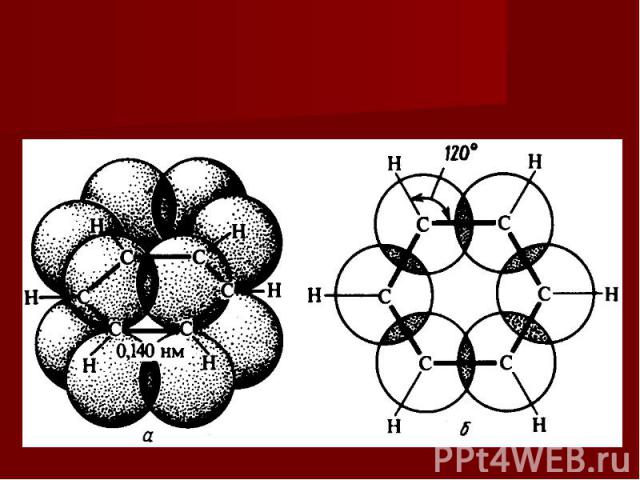
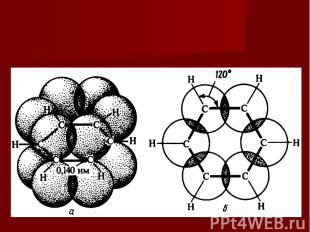
Образование σ-связей в бензольном кольце. Для бензольного ядра характерна SP2 - гибридизация. Два из трех гибридных электронных облака образуют две σ-связи между соседними атомами углерода, а третье –между атомами углерода и водорода:

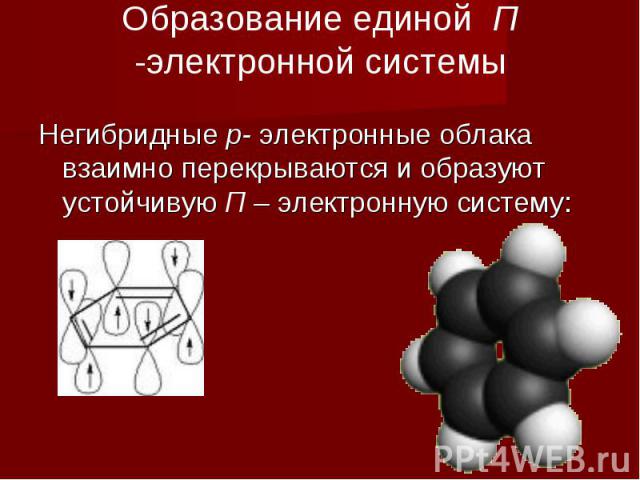
Образование единой П -электронной системы Негибридные р- электронные облака взаимно перекрываются и образуют устойчивую П – электронную систему:

Квантовомеханическая теория и молекула бензола Немецкий химик Э. Хюккель применил к ароматическим соединениям квантовомеханическую теорию и показал, что шесть π-электронов молекулы бензола располагаются в плоскости, перпендикулярной плоскости молекулы, взаимно перекрываются и образуют замкнутое электронное облако.

Понятие арены (ароматические углеводороды) Соединения углерода с водородом, в молекулах которых имеется бензольное кольцо, или ядро, относятся к ароматическим углеводородам.

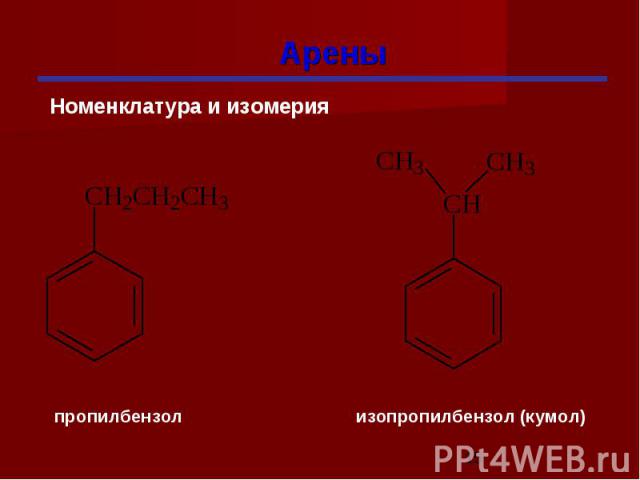
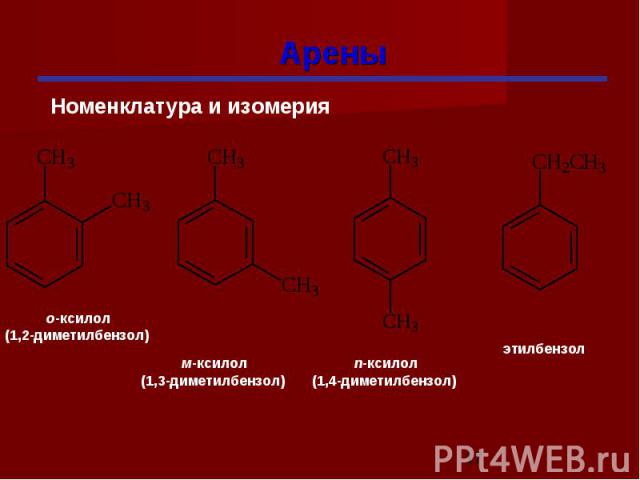
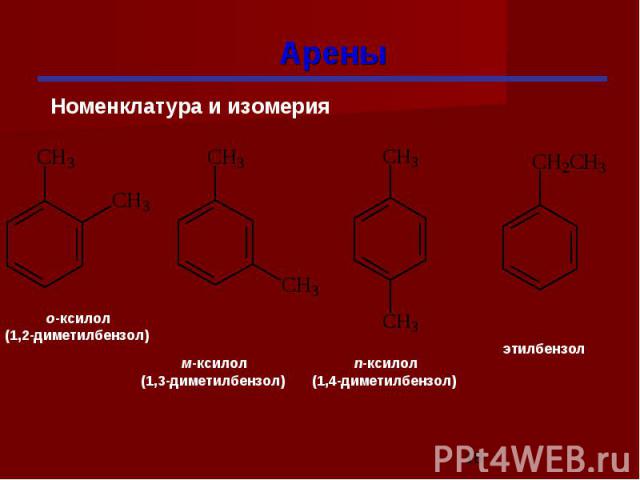
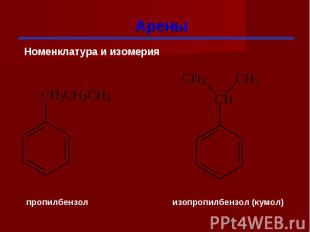
Гомологи бензола При замещении водородных атомов в молекуле бензола различными радикалами образуются гомологи бензола: C6Н5 –СН3 – метилбензол C6Н5 –С2Н5 – этилбензол C6Н5 –С3Н7 – пропилбензол Общая формула СnН2n-6

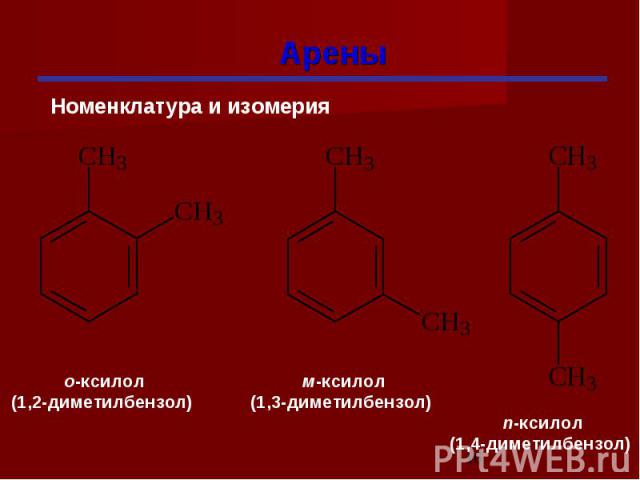
Изомерия гомологов бензола изомерия радикалов; количество радикалов; положение радикалов в бензольном ядре.
Арены
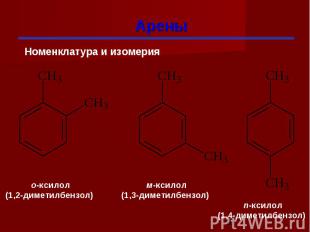
Арены
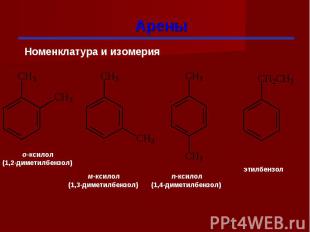
Арены
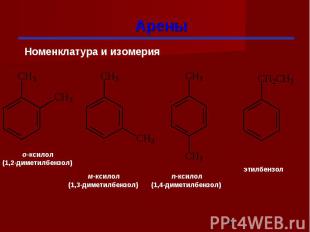
Арены

Физические свойства Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС. Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней. Пары бензола с воздухом образуют взрывчатую смесь.

Химические свойства 1.Горение бензола: 2С6Н6 + 15О2 = 12СО2 + 6Н2О 2. Реакция замещения: С6Н6 + Br2 C6H5Br + HBr 3. Нитрование: С6Н6 + НОNО2 С6Н5NО2 + Н2О 4. Гидрирование: С6Н6 + 3Н2 С6Н12 5. Хлорирование: С6Н6 + 3 Cl2 C6H6Cl6

Получение Бензол получают из каменноугольной смолы, образующейся при коксовании угля. В настоящее время бензол получают из нефти. Бензол получают синтетическими методами.
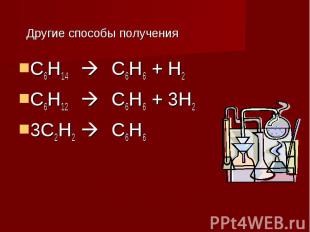
Другие способы получения С6Н14 С6Н6 + Н2 С6Н12 С6Н6 + 3Н2 3С2Н2 С6Н6

Природные источники получения: Природные и попутные газы Нефть Каменный уголь
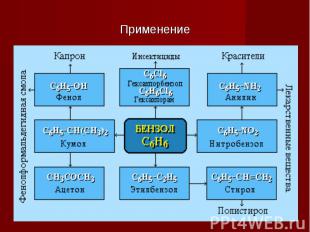
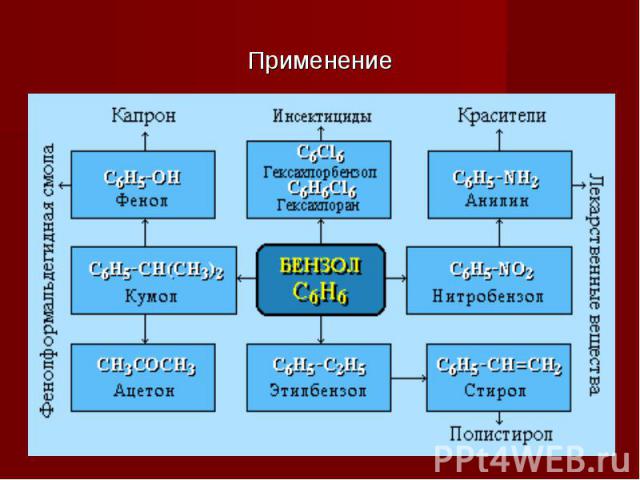
Применение

Проверь себя Выбери правильный ответ. 1. Бензол относится к гомологическому ряду: а) алканов; б) алкенов; в) алкинов; г) аренов. 2. Брутто-формула бензола - это: а) С6Н6; б) С6Н14; в) С6Н12; г) С6Н10

3. Бензол в воде: а) растворяется неограничено; б) не растворяется; в) растворяется при нагревании; г) не растворяется при нагревании. 4. Общая формула аренов: а) С2nН2n+2 ; б) С2nН2n ; в) С2nН2n-2 ; г) С2nН2n-6

5. Для бензольного ядра характерна а) sp гибридизация; 2 б) sp гибридизация; 3 в) sp гибридизация; 4 г) sp гибридизация. 6. Среди приведенных реакций укажите реакцию гидротации: а) С6Н6 + О2 → б) С6Н6 + НCl → в) С6Н6 + Н2→ г) С6Н6 + НNO3→