Презентация на тему: d-Элементы I Б группы.


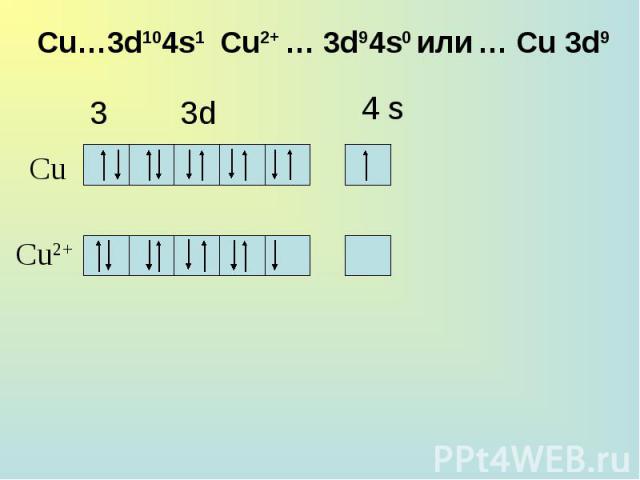
Общая характеристика группы. Общая характеристика группы. 28Cu 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1; [Xe] 4f145d106s2
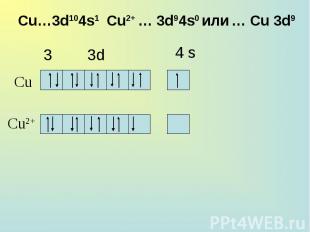


Для меди наиболее характерна степень окисления +2, для серебра +1, для золота +3. Особая устойчивость степени окисления +1 у серебра объясняется большей прочностью конфигурации 4d10, т. к. эта конфигурация образуется уже у Pd, предшествующего серебру в периодической системе. Для меди наиболее характерна степень окисления +2, для серебра +1, для золота +3. Особая устойчивость степени окисления +1 у серебра объясняется большей прочностью конфигурации 4d10, т. к. эта конфигурация образуется уже у Pd, предшествующего серебру в периодической системе.

Радиусы атомов элементов побочной подгруппы I группы гораздо меньше, чем у металлов главной подгруппы, поэтому медь, серебро и золото отличаются большей плотностью, высокими температурами плавления. Радиусы атомов элементов побочной подгруппы I группы гораздо меньше, чем у металлов главной подгруппы, поэтому медь, серебро и золото отличаются большей плотностью, высокими температурами плавления.

При переходе от меди к серебру радиус атомов увеличивается, а у золота не изменяется, т. к. золото расположено в периодической системе после лантаноидов и еще испытывает эффект лантаноидного сжатия. Плотность золота очень велика. При переходе от меди к серебру радиус атомов увеличивается, а у золота не изменяется, т. к. золото расположено в периодической системе после лантаноидов и еще испытывает эффект лантаноидного сжатия. Плотность золота очень велика. Химическая активность этих элементов невелика и убывает с возрастанием порядкового номера элемента.

Нахождение в природе. Нахождение в природе. В природе встречается в виде различных соединений, Cu2S - медный блеск, CuFeS2 - медный колчедан (халькопирит), Cu3FeS3 - борнит, Сu2 (ОН)2 СО3 или СuСО3 Сu(ОН)2 - малахит.

Медь Сu Медь Сu довольно мягкий металл красного цвета, Tпл = 1083°С, обладает высокой электро- и теплопроводностью, образует различные сплавы.

Способы получения. Способы получения. Продувание О2 через расплав сульфида меди (I): 2Cu2S + 3О2 = 2Cu2O + 2SO2; 2Cu2O + Cu2S = 6Cu + SO2.


2Сu + О2 = 2СuО (800°С); 2Сu + О2 = 2СuО (800°С); Сu + S = CuS (350°C); Сu + Сl2 =СuСl2; 2Сu + О2 + H2О + СО2 = (СuОН)2СО3 (пленка зеленого цвета – образуется на воздухе);
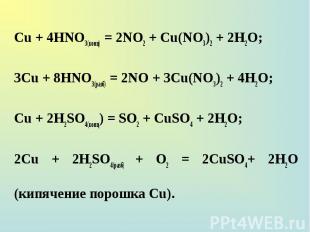
Сu + 4НNО3(конц) = 2NO2 + Cu(NO3)2 + 2Н2О; Сu + 4НNО3(конц) = 2NO2 + Cu(NO3)2 + 2Н2О; 3Сu + 8НNО3(разб) = 2NO + 3Cu(NO3)2 + 4Н2О; Сu + 2H2SO4(конц) = SO2 + CuSO4 + 2H2О; 2Сu + 2H2SO4(paзб) + О2 = 2CuSO4+ 2H2O (кипячение порошка Сu).

Оксид меди (I) Сu2О - твердое вещество темно-красного цвета, обладает основными свойствами. Оксид меди (I) Сu2О - твердое вещество темно-красного цвета, обладает основными свойствами. Часть солей меди (I) растворима в воде, но легко окисляется кислородом воздуха, устойчивы комплексные соединения меди (I) [Cu(NH3)2]+:

Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О + 8НСl(разб) + О2 = 4CuCl2 + 4Н2О; 2Сu2О + 4Н2О + О2 = 4Сu(ОН)2; Сu2О + СО = 2Сu + СО2. Гидроксид Cu(OH) не стоек и быстро окисляется.

Оксид меди (II) СuО - твердое вещество красно-коричневого цвета, проявляет основные свойства. Оксид меди (II) СuО - твердое вещество красно-коричневого цвета, проявляет основные свойства. 4CuO = 2Cu2O+ O2; СuО + Н2 = Сu + Н2О; 3СuО + 2А1 = 3Сu + Аl2О3; СuО + С = Сu + СО;

СuО + СО = Сu + СО2; СuО + СО = Сu + СО2; 3СuО + 2NH3(г) = N2 + 3Сu + 3H2О; СuО + 2НС1 = СuСl2 + Н2O Слабые амфотерные свойства проявляются при сплавлении со щелочами: СuО + 2NaOH = Na2СuO2 + Н2O

Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета, не растворим в воде, термически неустойчив, преобладают основные свойства, слабый окислитель: Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета, не растворим в воде, термически неустойчив, преобладают основные свойства, слабый окислитель: CuSO4 + 2NaOH(разб.) = Cu(OH)2↓ + Na2SO4; Cu(OH)2 + 2HCl = CuCl2 + 2H2O; Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]; Купраты щелочных металлов имеют синюю окраску

2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3 - + H2O; 2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3 - + H2O; Cu(OH)2 = CuO + 2H2O; Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O; качественная реакция на альдегиды: 2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O

Соединения меди (II) – окислители: Соединения меди (II) – окислители: CuSO4+ M = Cu + MSO4 (М = Fе, Zn) 2CuSO4 + 2NaE + SO2 + 2H2O = 2CuE + 2H2 SO4 + 2Na2SO4 (E =Cl, Br , I, NCS)

Соли меди (II) сильных кислот подвергаются в водных растворах значительному гидролизу. Катион находится в гидратированном состоянии: Соли меди (II) сильных кислот подвергаются в водных растворах значительному гидролизу. Катион находится в гидратированном состоянии: Cu2+ + Н2О CuOH + + Н+; Сu2++ 4Н2О [Cu(H2O)4]3+ [Cu(H2O)4]2+ + Н2О [Cu(OH)(H2O)3]+ + Н3О+ гидролиз в протолитической форме

Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. [Cu(NH3)4](OH)2 Свойство Сu (ΙΙ) реагировать с белками и пептидами, а также с биуретом (NH2 –CO–NH–CO–NH2) в щелочной среде с образованием окрашенных в сине-фиолетовый цвет комплексных соединений, используют для доказательства наличия пептидных связей. Реакция Сu (ΙΙ) с биуретом и белками называется биуретовой.

Серебро. Серебро. Серебро Ag - тяжелый пластичный металл с характерным блеском, Тпл = 962°С, обладает наибольшей среди металлов электро- и теплопроводностью, образует сплавы со многими металлами.


Является малоактивным (благородным) металлом, непосредственно не взаимодействует с О2, не реагирует с разбавленными растворами НСl, H2SO4 Является малоактивным (благородным) металлом, непосредственно не взаимодействует с О2, не реагирует с разбавленными растворами НСl, H2SO4
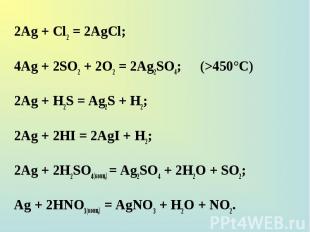
2Ag + Cl2 = 2AgCl; 2Ag + Cl2 = 2AgCl; 4Ag + 2SO2 + 2O2 = 2Ag2SO4; (>450°C) 2Ag + H2S = Ag2S + H2; 2Ag + 2HI = 2AgI + H2; 2Ag + 2H2SO4(конц.) = Ag2SO4 + 2H2O + SO2; Ag + 2НNO3(конц.) = AgNO3 + H2O + NO2.

Оксид серебра Ag2O - твердое вещество темно-коричневого цвета, Оксид серебра Ag2O - твердое вещество темно-коричневого цвета, разлагается при нагревании, проявляет основные свойства, плохо растворяется в НСI и H2SO4 за счет образования на поверхности солей AgCl и Ag2SO4,
![2Ag2O = 4Ag + О2; (150°С) 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]O 2Ag2O = 4Ag + О2; (150°С) 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]O](https://fs1.ppt4web.ru/images/95369/132767/310/img27.jpg)
2Ag2O = 4Ag + О2; (150°С) 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О; Ag2O + H2О2(конц) = 2Ag + О2 + Н2О.

Соли серебра. Соли серебра. Соли серебра не растворимы в воде, исключение составляют AgF, AgNO3, AgClO3, AgClO4. Взаимодействие с гидратом аммиака, тиосульфатом натрия, карбонатом аммония (повторить качественные реакции на галогениды – НЛВ).




Химические основы применения соединений серебра в качестве лечебных препаратов в фармацевтическом анализе Химические основы применения соединений серебра в качестве лечебных препаратов в фармацевтическом анализе Растворимые соли серебра, попадая в организм в больших дозах, вызывают острое отравление, подобно другим тяжелым элементам-металлам. При этом, как правило, серебро связывается атомами серы белков. В результате инактивируются соответствующие ферменты, свертываются белки.

Вода, содержащая ионы серебра порядка 10-8 ммоль/л, обладает бактерицидным действием, что обусловлено образованием нерастворимых альбуминатов. Вода, содержащая ионы серебра порядка 10-8 ммоль/л, обладает бактерицидным действием, что обусловлено образованием нерастворимых альбуминатов. Эффективность бактерицидного действия серебра выше, чем у хлора, хлорной извести, карболовой кислоты.

Золото Au – Золото Au – желтый, ковкий, тяжелый металл, Тпл = 1064°С, благородный металл. Нахождение в природе. Встречается в виде самородного золота


Не реагирует с водой, кислотами, щелочами, кислородом, азотом, углеродом, серой. Не реагирует с водой, кислотами, щелочами, кислородом, азотом, углеродом, серой. Переводится в раствор "царской водкой", со ртутью образует амальгаму, при нагревании взаимодействует с галогенами.
![Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; Au + НNО3(конц) + 4НСl(конц Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; Au + НNО3(конц) + 4НСl(конц](https://fs1.ppt4web.ru/images/95369/132767/310/img37.jpg)
Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3 (130°С)

Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3 + 3H2O Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O Au(OH)3 + NaOH = Na[Au(OH)4] - гидроксоаурат (III)

Соединения Au (III) проявляют окислительные свойства: Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2 + HCl H[AuCl4] +SO2+H2O →H[AuCl2]+H2SO4 + HCl

Подобрать коэффициенты: Cu2S+HNO3(конц.,хол.)→Cu(NO3)2+S +NO2 +H2O Подобрать коэффициенты: Cu2S+HNO3(конц.,хол.)→Cu(NO3)2+S +NO2 +H2O CuS +8HNO3 (конц., гор.) → CuSO4+8NO2 + 4Н2О. Cu2S + Cu2O → Cu + SO2


![Общая характеристика группы. Общая характеристика группы. 28Cu 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1; [Xe] 4f145d106s2 Общая характеристика группы. Общая характеристика группы. 28Cu 1s22s22p63s23p63d104s1; [Ar] 3d104s1 47Ag 1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1 79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1; [Xe] 4f145d106s2](https://fs1.ppt4web.ru/images/95369/132767/640/img1.jpg)









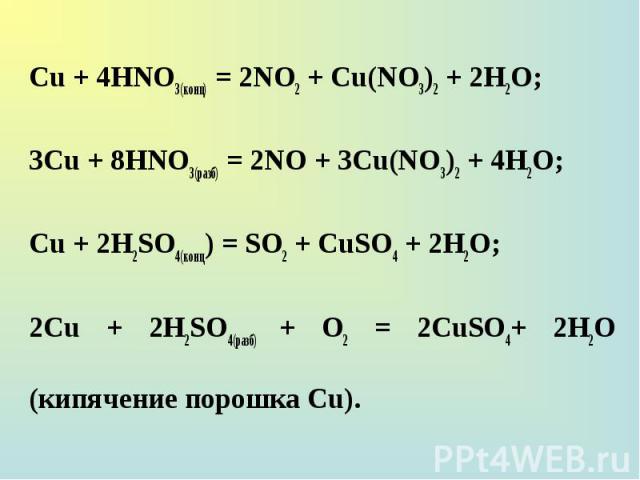

![Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О + 8НСl(разб) + О2 = 4CuCl2 + 4Н2О; 2Сu2О + 4Н2О + О2 = 4Сu(ОН)2; Сu2О + СО = 2Сu + СО2. Гидроксид Cu(OH) не стоек и быстро окисляется. Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 2НСl(разб) = 2CuCl + H2O; Сu2О + 4НСl(изб.) = 2H[CuCl2] + H2O; 2Сu2О + 8НСl(разб) + О2 = 4CuCl2 + 4Н2О; 2Сu2О + 4Н2О + О2 = 4Сu(ОН)2; Сu2О + СО = 2Сu + СО2. Гидроксид Cu(OH) не стоек и быстро окисляется.](https://fs1.ppt4web.ru/images/95369/132767/640/img14.jpg)



2 + 4H2O; качественная реакция на альдегиды: 2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O 2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3 - + H2O; 2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3 - + H2O; Cu(OH)2 = CuO + 2H2O; Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O; качественная реакция на альдегиды: 2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O](https://fs1.ppt4web.ru/images/95369/132767/640/img18.jpg)


2 Свойство Сu (ΙΙ) реагировать с белками и пептидами, а также с б… Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными спиртами. [Cu(NH3)4](OH)2 Свойство Сu (ΙΙ) реагировать с белками и пептидами, а также с б…](https://fs1.ppt4web.ru/images/95369/132767/640/img21.jpg)



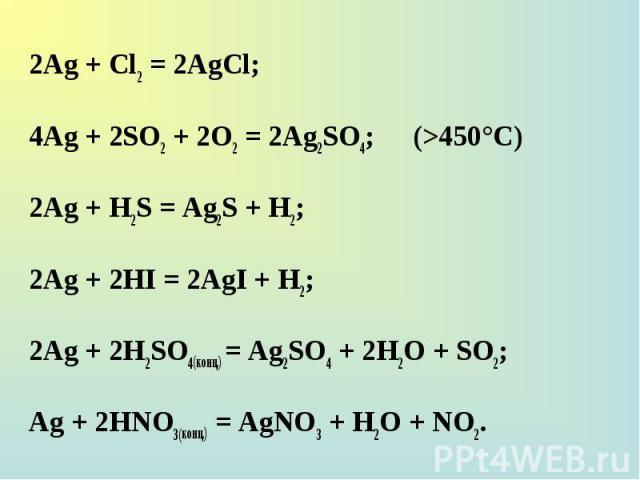

![2Ag2O = 4Ag + О2; (150°С) 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О; Ag2O + H2О2(конц) = 2Ag + О2 + Н2О. 2Ag2O = 4Ag + О2; (150°С) 2Ag2O = 4Ag + О2; (150°С) Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О; Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О; Ag2O + H2О2(конц) = 2Ag + О2 + Н2О.](https://fs1.ppt4web.ru/images/95369/132767/640/img27.jpg)









![Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3 (130°С) Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О; 2Au + 3Сl2 = 2AuCl3 (130°С)](https://fs1.ppt4web.ru/images/95369/132767/640/img37.jpg)
![Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3 + 3H2O Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O Au(OH)3 + NaOH =… Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Оксид и гидроксид золота (III) нерастворимы в воде, проявляют амфотерные свойства: Au(OH)3 + 3HCl = AuCl3 + 3H2O Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O Au(OH)3 + NaOH =…](https://fs1.ppt4web.ru/images/95369/132767/640/img38.jpg)
![Соединения Au (III) проявляют окислительные свойства: Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2 + HCl H[AuCl4] +SO2+H2O →H[AuCl2]+H2SO4 + HCl Соединения Au (III) проявляют окислительные свойства: Соединения Au (III) проявляют окислительные свойства: Подобрать коэффициенты: AuCl3 + H2O2 (конц.) → Au (коллоид) +O2 + HCl H[AuCl4] +SO2+H2O →H[AuCl2]+H2SO4 + HCl](https://fs1.ppt4web.ru/images/95369/132767/640/img39.jpg)












