Презентация на тему: Цифровой образовательный ресурс "Химические реакции"

Классификация химических реакций Маланина Елена Алексеевна Учитель химии МОУ Большевяземская гимназия, р.п. Большие Вяземы, Одинцовский район, Московская область

Химические реакции - это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и строению

Классификация По числу и составу реагирующих веществ По изменению степени окисления химических элементов, образующих вещества По тепловому эффекту По агрегатному состоянию реагирующих веществ По участию катализатора По направлению

По числу и составу реагирующих веществ Реакции, идущие без изменения состава веществ Реакции, идущие с изменением состава вещества

По изменению степени окисления Окислительно-восстановительные Реакции, идущие без изменения степеней окисления химических элементов

По тепловому эффекту Экзотермические Эндотермические

По агрегатному состоянию реагирующих веществ Гомогенные Гетерогенные

По участию катализатора Каталитические Некаталитические

По направлению Необратимые Обратимые

Получение аллотропных модификаций C (графит) C (алмаз)

С изменением состава Соединения Разложения Замещения Обмена

Реакции соединения – из двух и более веществ образуется одно более сложное 2H2 + O2 2H2O 2Na + Cl2 2NaCl Решить: Ca + O2 Na + S H2 + Br2

Реакции разложения – из одного вещества образуется два и более 2HgO 2Hg + O2 2KNO3 2KNO2 + O2 Решить: Fe(OH)2 MgCO3

Реакции замещения – атомы простого вещества замещают атомы в сложном веществе Mg + 2HCl MgCl2 + H2 Zn + CuSO4 ZnSO4 + Cu Решить: Zn + H2SO4 CuO + H2

Реакции обмена – вещества обмениваются своими составными частями CO2+Ca(OH)2 CaCO3 +H2O K2S + 2HCl H2S + 2KCl NaOH + HNO3 NaNO3 + H2O Решить: KOH + HCl AgNO3 + HCl MgCl2 + K2CO3

Окислительно-восстановительные реакции 0 0 +4 -2 C + O2 CO2 0 +4 C – 4e C восстановитель процесс окисления 0 - 2 O2 + 4e 2O окислитель процесс восстановления Решить: Mg + O2

Реакции протекающие без изменения степени окисления + -2 + -2 + -2 + Li2O + H2O 2LiOH +2 +4 -2 +2 -2 +4 -2 CaCO3 CaO + CO2 Решить: Na2O + H2O Cu(OH)2

Экзотермические - реакции протекающие с выделением теплоты 4P + 5O2 2P2O5 + Q CH4+2O2 CO2+2H2O + Q

Эндотермические – реакции протекающие с поглощением теплоты N2 +O2 2NO – Q H2 + I2 2HI – Q

Гомогенные – реакции в которых исходные вещества и продукты реакции находятся в одном агрегатном состоянии H2 (г) + F2(г) 2HF(г) Fe(т) + S(т) FeS (т)

Гетерогенные - реакции в которых исходные вещества и продукты реакции находятся в разных агрегатных состояниях Ca(т) + 2H2O(ж) Ca(OH)2(р-р) +H2(г)

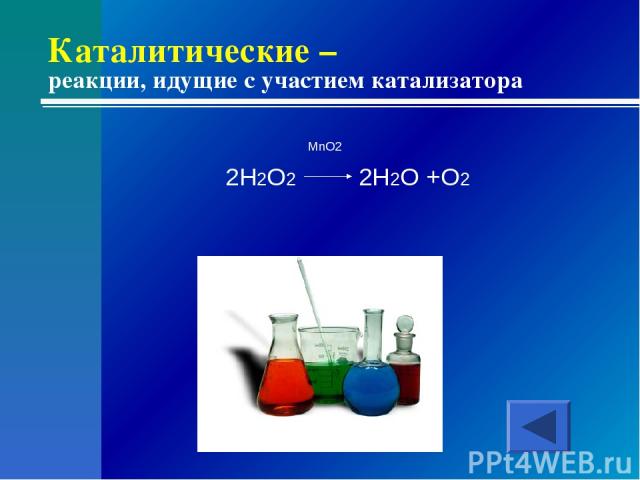
Каталитические – реакции, идущие с участием катализатора MnO2 2H2O2 2H2O +O2
Некаталитические – реакции, идущие без участия катализатора C2H4+O2 CO2+H2O
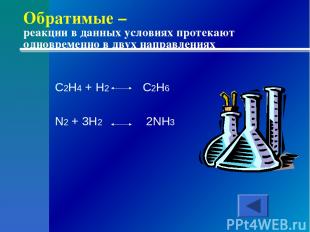
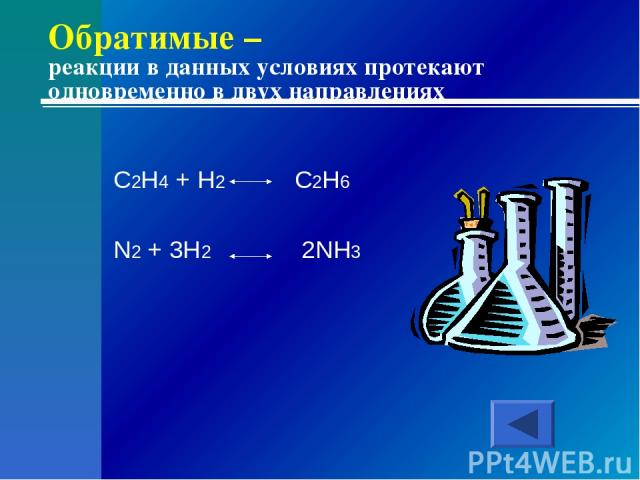
Обратимые – реакции в данных условиях протекают одновременно в двух направлениях C2H4 + H2 C2H6 N2 + 3H2 2NH3

Необратимые – реакции в данных условиях протекают только в одном направлении H2SO4+BaCl2 BaSO4 + 2HCl 2Na+2H2O 2NaOH+H2

Составим характеристику процесса синтеза аммиака 0 0 Fe – 3 + N2 (г) + 3H2 (г) NH3 (г) + Q Реакция: Соединения Окислительно-восстановительная Экзотермическая Обратимая Каталитическая Гетерогенная

Вывод: Классификация химических реакций условна. Ученые договорились разделить реакции на определенные типы по выделенным признакам Большинство реакций можно отнести к разным типам