Презентация на тему: Азот и его свойства

История одного открытия Генри Кавендиш Джозеф Пристли Даниэль Рутерфорд Лавуазье, Антуан Лоран

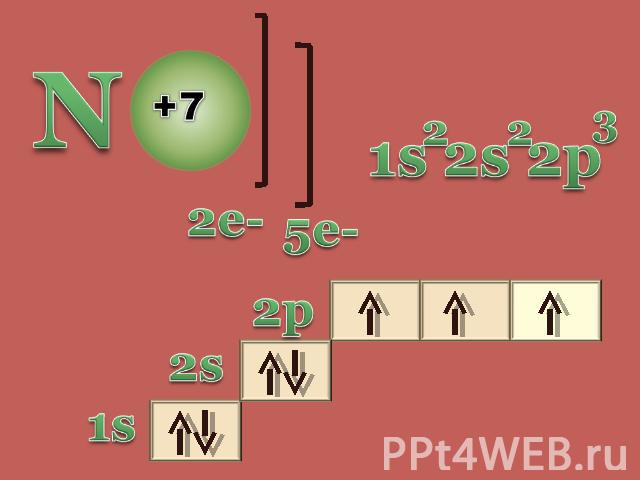
Азот и его свойства Строение атома азота Физические свойства Химические свойства

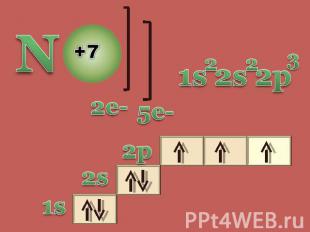

Возможные степени окисления

молекулярная формула структурная формула электронная формула

азот - простое вещество

Химические свойства


получение в лаборатории NH4NO2 → N2 + 2H2О в промышленности Выделение из сжиженного воздуха

Жидкий азот в медицине Синтез аммиака Производство удобрений Синтез азотной кислоты Создание инертной среды
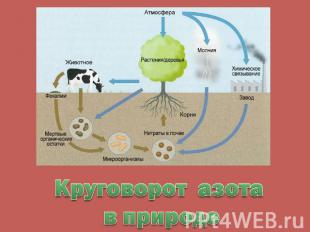
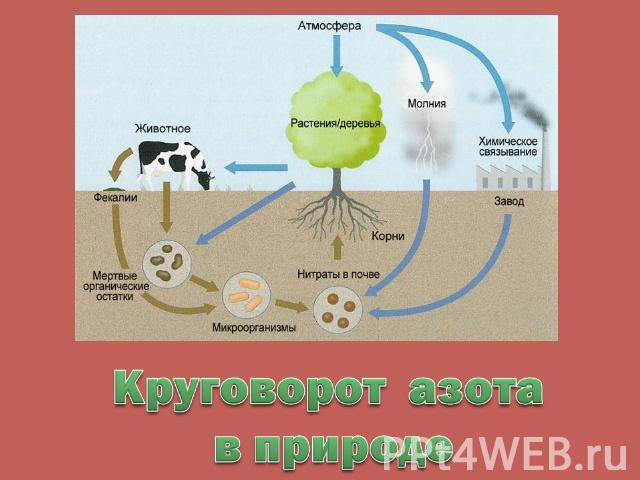
Круговорот азота в природе

А1. Сумма протонов, нейтронов, электронов в атоме 14N 1) 7 2) 14 3) 28 4) 21 А2. Химические элементы расположены в порядке возрастания их атомных радиусов 1) N, C, B 3) N, O, F 2) N, P, As 4) B, Si, N

А3. Химическая связь в молекуле азота 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная А4. Наибольшая степень окисления азота в соединении 1) HNO3 2) NO2 3) NO 4) HNO2

А5. Сумма коэффициентов в уравнении реакции между азотом и водородом равна 1) 2 2) 3 4) 5 4) 6 А6. К реакции разложения относится 1) N2 + 3H2 = 2NH3 2) N2 + O2 = 2NO 3) 6Li + N2 = 2Li 3N 4) NH 4NO2 = N2 + 2H 2O

А7. Азот является восстановителем в реакции 1) N2 + 3H2 = 2NH3 2) N2 + O2 = 2NO 3) 6Li + N2 = 2Li 3N 4) N2 + 3Ca = Ca 3N2