Презентация на тему: Алюминий – крылатый металл. Этому металлу принадлежит будущее

«Алюминий – крылатый металл. Этому металлу принадлежит будущее» Н. Г. Чернышевский

«Открытие алюминия» В 1825 г. датский физик Ханс Кристиан Эрстед был первым, кому удалось, подобно неизвестному мастеру Древнего Рима, получить относительно чистый алюминий; поскольку сообщение об этом было опубликовано в малоизвестном датском журнале и не сразу стало известно химикам, иногда первооткрывателем алюминия называют Ф. Вёлера.

«Серебро из глины» Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со щелочными металлами: калием и натрием.А.Сент-Клер Девиль.Впервые получил алюминий промышленным способом (1855г.).

«Электролитический способ» В 1886 году Поль Эру французский инженер-химик запатентовал открытие способа получения алюминияЧарльз Мартин Холл американский ученый
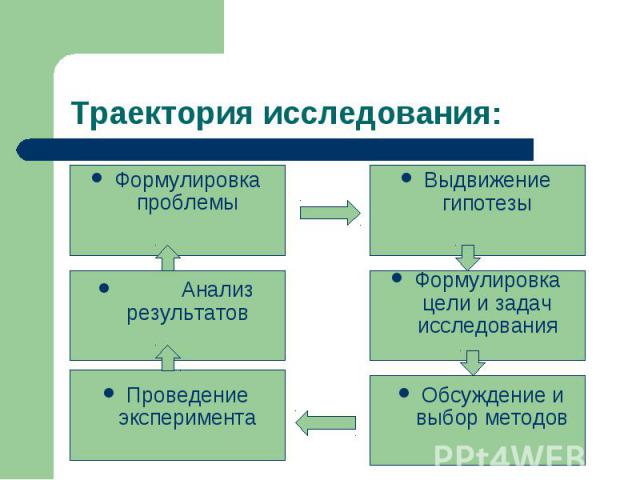
Траектория исследования:

Проблемный вопрос: «Алюминий – металл будущего?»
Характеристика алюминия
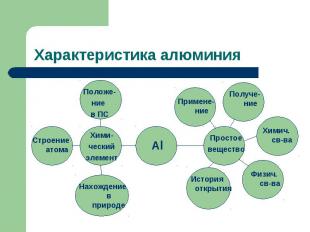
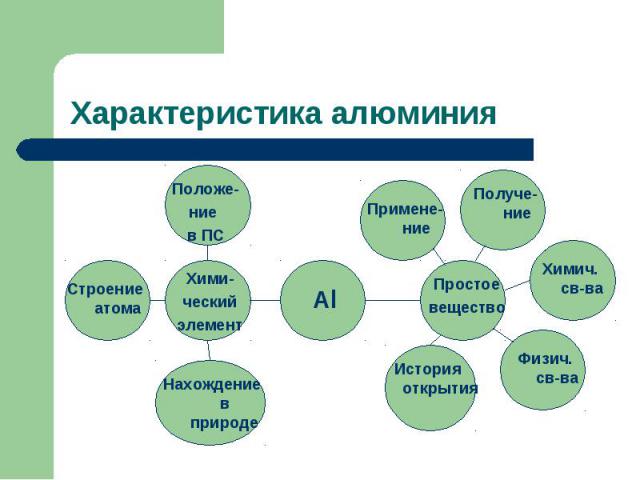
Характеристика алюминия

Цель и задачи исследования: Ответить на вопрос: « Почему алюминий называют металлом будущего?»Дать характеристику элемента по его положению в периодической системе химических элементов. На основе строения атома рассмотреть его физические и химические свойства, указать области применения алюминия.

Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 .Алюминий - элемент III группы, главной подгруппы.Заряд ядра атома алюминия равен +13.В ядре атома алюминия 13 протонов.В ядре атома алюминия 14 нейтронов.В атоме алюминия 13 электронов.Атом алюминия имеет 3 энергетических уровня.Электронная оболочка имеет строение 2е, 8е, 3е.На внешнем уровне в атоме 3 электронов.Степень окисления атома в соединениях равна +3 .Простое вещество алюминий является металлом.

Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 .Алюминий - элемент III группы, главной подгруппы.Заряд ядра атома алюминия равен +13.В ядре атома алюминия 13 протонов.В ядре атома алюминия 14 нейтронов.В атоме алюминия 13 электронов.Атом алюминия имеет 3 энергетических уровня.Электронная оболочка имеет строение 2е, 8е, 3е.На внешнем уровне в атоме 3 электронов.Степень окисления атома в соединениях равна +3 .Простое вещество алюминий является металлом.
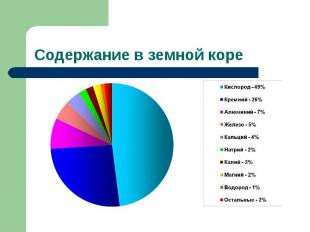
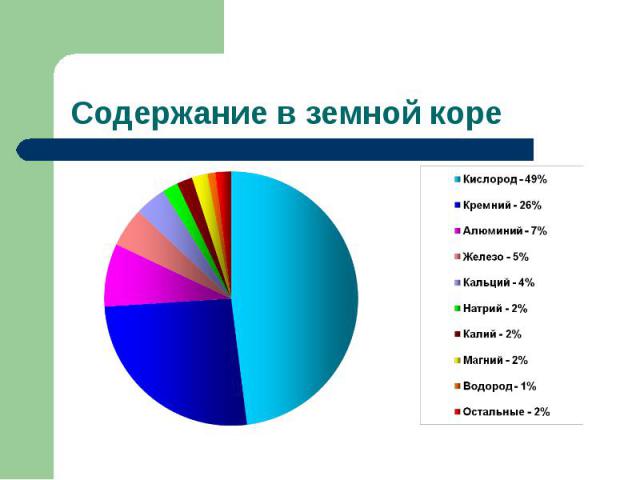
Содержание в земной коре

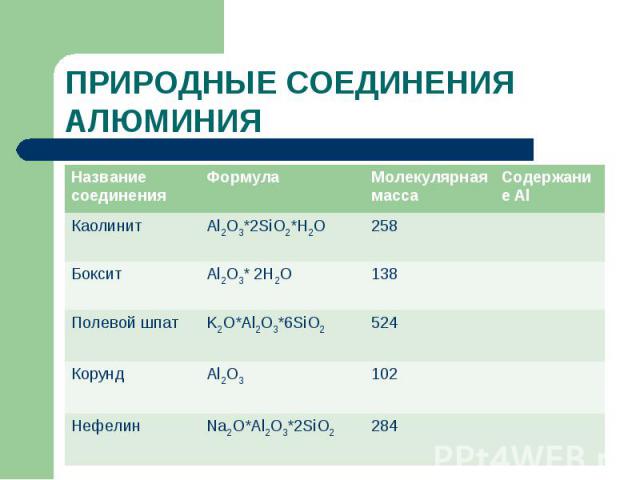
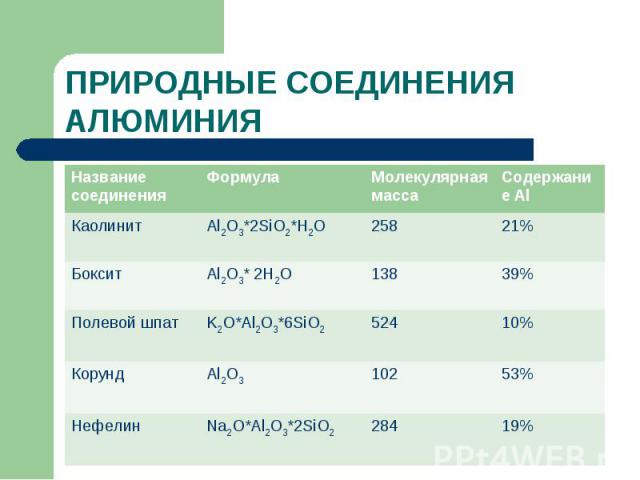
ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ

ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ

Физические свойства Цвет – серебристо-белыйt пл. = 660°C.t кип. ≈ 2450°C.Электропроводный, теплопроводныйЛегкий, плотность ρ = 2,6989 г/см3Мягкий, пластичный.
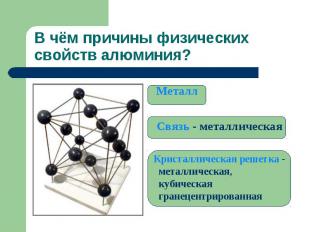
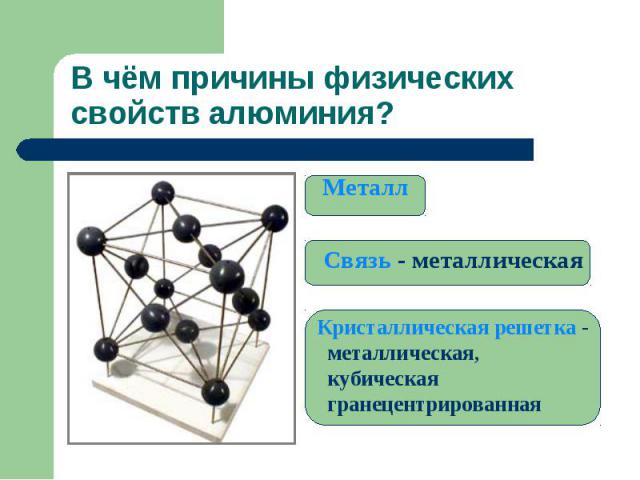
В чём причины физических свойств алюминия? Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная

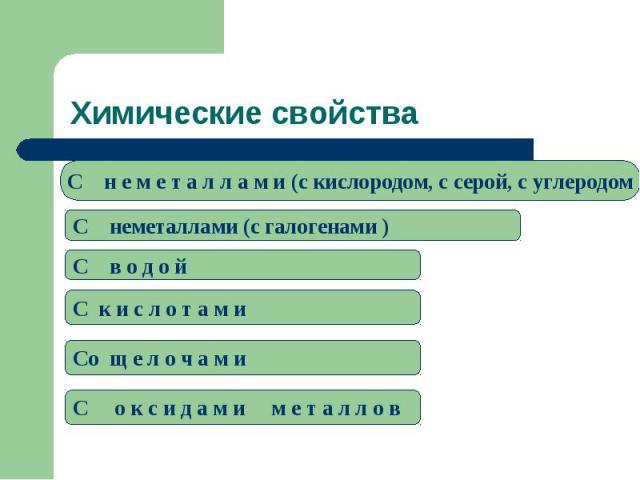
Химические свойстваC н е м е т а л л а м и (c кислородом, с серой, с углеродомC неметаллами (c галогенами )C в о д о й C к и с л о т а м и Cо щ е л о ч а м иC о к с и д а м и м е т а л л о в


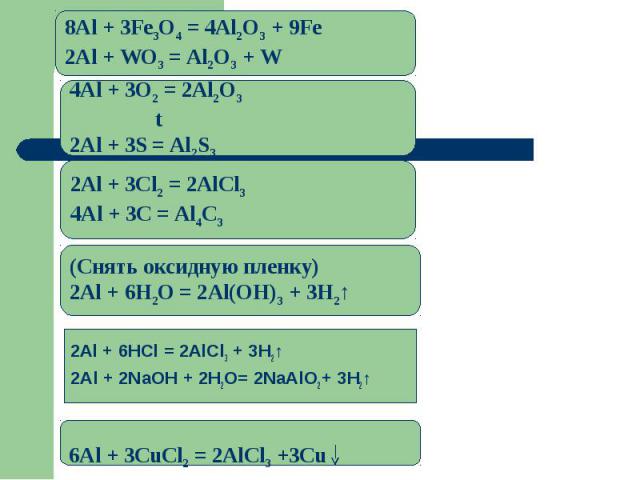
8Al + 3Fe3O4 = 4Al2O3 + 9Fe2Al + WO3 = Al2O3 + W 4Аl + 3O2 = 2Al2O3 t2Al + 3S = Al2S32Аl + 3Cl2 = 2AlCl34Al + 3C = Al4C3(Снять оксидную пленку)2Al + 6H2O = 2Al(OH)3 + 3H2↑2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 2NaOH + 2H2O= 2NaAlO2+ 3H2↑6Al + 3CuCl2 = 2AlCl3 +3Cu

Химические свойства Алюминий - очень активный металл.В реакциях он проявляет восстановительные свойства.Реагирует с простыми веществами – неметаллами.Восстанавливает металлы, стоящие в электрохимическом ряду напряжения справа от него.« Пассивность» алюминия связана с наличием оксидной пленки.

Применение алюминия

Металл будущего Вывод: Алюминий – самый распространенный металл в земной коре.Обладает высокой коррозийной стойкостью.Малая плотность, легкий.Высокая электропроводность и теплопроводность. Сплавы на основе алюминия обладают прочностью.