Презентация на тему: Модели атомов Опыт Резерфорда

Модели атомов Опыт Резерфорда
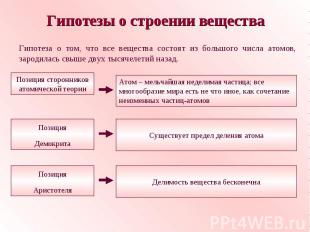
Гипотезы о строении веществаГипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад.

Развитие представлений о строении атомаКонкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. В начале 19 века молекулярно-кинетическая теория установила примерные размеры атомов и небольших молекул: около 10-10 м В конце 19 века был открыт электрон, а также измерена его масса и заряд В.Вебер впервые высказывает мысль об электронном строении атома Х.Лоренц в 1896 году создал электронную теорию: электроны входят в состав атома в 1896 году А.Беккерель открыл явление радиоактивности

Модель атома ТомсонаОпираясь на открытия сделанные в то время, Джозеф Джон Томсон в 1903 году предложил одну из первых моделей строения атома в виде положительно заряженного шара радиусом 10-10 м, в котором «плавают» электроны, нейтрализующие положительный заряд, равномерно распределенный по всему объему. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд равен по модулю суммарному отрицательному заряду электронов.

Опыты РезерфордаВ 1911 году Резерфорд экспериментально подвергнул проверке модель атома Томсона.Пропуская пучок α-частиц (заряд +2е, масса 6,64 · 10-27 кг) через тонкую золотую фольгу, Эрнест Резерфорд обнаружил, что какая-то часть частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть α-частиц отражается от фольги. Но согласно модели атома Томсона, эти α-частицы при взаимодействии с атомами фольги должны отклоняться на малые углы, порядка 2˚.

Опыты РезерфордаРезерфорд показал, что модель Томсона находится в противоречии с его опытами.Результаты эксперимента настолько удивили Резерфорда, что он воскликнул: «… неправдоподобно так же, как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, а снаряд отскочил бы обратно и убил бы вас самих».

Опыты РезерфордаИзвестно, что α-частицы имеют положительный заряд. Если некоторые из них отталкиваются фольгой назад, значит, положительный заряд есть и в атомах фольги. Но поскольку большая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь при этом, значит, положительный заряд занимает лишь малую часть каждого атома. Её назвали ядром атома.При столкновениях с отдельными электронами α-частицы испытывают отклонения на очень небольшие углы, так как масса электрона мала. Однако в тех редких случаях, когда она пролетает на близком расстоянии от одного из атомных ядер, под действием сильного электрического поля ядра может произойти отклонение на большой угол.

Модель атома РезерфордаРезерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома: атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (dя ≈ 10-12 – 10-13 см); в ядре сконцентрирована почти вся масса атома; отрицательный заряд всех электронов распределён по всему объему атома

Модель атома Резерфорда Поскольку диаметр ядра значительно меньше диаметра атома, то быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов. Резерфорд ничего не говорит о том, как именно в атоме расположены электроны и движутся ли они. Он и не мог дать ответ на этот вопрос в рамках той физики, которая развивалась до начала ХХ века. Классическая физика просто не допускала существование такого атома. Для этого потребовалось создание новой, квантовой физики. Её основу заложили труды таких выдающихся ученых, как Нильс Бор и Альберт Эйнштейн.

Ответьте на вопросы: Что представляет собой атом, согласно модели Томсона? Как проводился опыт по рассеянию α-частиц? Какие выводы были сделаны Резерфордом, когда он обнаружил, что α-частицы отклоняются при взаимодействии с фольгой? Что представляет собой атом, согласно ядерной модели, выдвинутой Резерфордом? Как проходят α-частицы сквозь атомы вещества согласно ядерной модели? Почему отрицательно заряженные частицы атома не оказывают заметного влияния на рассеяние α-частиц? Почему α-частицы не могли бы рассеиваться на большие углы, если бы положительный заряд атома был распределён по всему объёму?

Выберите правильный ответВ состав ядра атома входят следующие частицы: А. Только протоны. Б. Нейтроны и протоны. В. Протоны и электроны. Г. Нейтроны и электроны.Ядерная модель атома представляет из себя: А. положительно заряженный шар радиусом 10-10 м, в котором «плавают» электроны, нейтрализующие положительный заряд. Б. Вся масса атома сконцентрирована в ядре, которое имеет положительный заряд. Вокруг ядра подобно планете вращаются электроны. В. Комбинация центрального положительного атома, равномерно размазанного по сфере, и электронов, которые располагаются по сферическим концентрическим поверхностям.

3) Кто предложил ядерную модель строения атома? А. Беккерель Б. Гейзенберг В. Томсон Г. Резерфорд4) С помощью опытов Резерфорд установил, что … А. Положительный заряд распределен равномерно по всему объему атома. Б. Положительный заряд сосредоточен в центре атома и занимает очень малый объем. В. В состав атома входят электроны. Г. Атом не имеет внутренней структуры.5) Современная модель структуры атома обоснована опытами: А. По рассеянию α-частиц Б. По сжимаемости жидкости В. По электризации Г. По тепловому расширению

Проверь себя ... Б Б Г Б А

Домашнее задание § 56, 57 учебник Физика- 9 класс, Перышкин А.В. ответить на вопросы после параграфа выполнить буклет на одну из предложенных тем :«Эрнест Резерфорд. Опыты по рассеиванию α-частиц»«Планета по имени атом»«Модели строения атома»