Презентация на тему: Естествознание

Концепции современного естествознания Кузнецов Л.М. www.se.engec.ru www.webeco.narod.ru Литература: Масленникова И.С. и др. Концепции современного естествознания. Учебник. – СПб, ИНЖЭКОН, 2002г 900igr.net

Современное естествознание. Определение, предмет и цели КСЕ – это междисциплинарный синтез физики, химии и биологии на основе историко-философского и эволюционно-синергетического подходов к современному естествознанию. Предмет изучения в естествознании – различные формы движения материи в природе. Цели естествознания: определять сущность явлений природы, их законы и на этой основе предвидеть или создавать новые явления раскрывать возможность использования на практике познанных законов, сил и веществ природы. познание истины (законов природы) – непосредственная или ближайшая цель естествознания содействие их практическому использованию – конечная цель естествознания.

Задачи естествознания: Раскрытие всеобщих связей явлений природы Раскрытие сущности явлений Раскрытие принципов развития природы Выяснение соотношения между материей и сознанием Выявление качественных различий в природе (микромир и макромир) и.др.

Наука. Наука и культура. Структура современной системы наук. Наука - сфера человеческой деятельности, имеющая своей целью сбор, накопление, классификацию, анализ, обобщение, передачу и использование достоверных сведений, построение новых или улучшение существующих теорий, позволяющих адекватно описывать природные (естественные науки, естествознание) или общественные (гуманитарные науки) процессы и прогнозировать их развитие. Кроме того, под наукой часто подразумевается вся сложная система знаний, полученных в результате этой деятельности и составляющих научную картину мира. Культура - система отношений между человеком и миром..
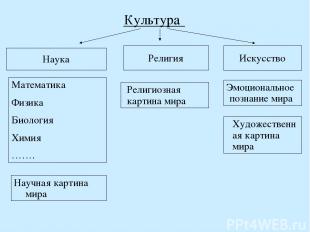
Культура Наука Религия Искусство Математика Физика Биология Химия ……. Научная картина мира Эмоциональное познание мира Художественная картина мира Религиозная картина мира

Наука: Естественные: Астрономия Биология Геология Медицина Почвоведение Физика Химия …………. Технические: Баллистика Бионика Биотехнологии Геомеханика Геофизика Информатика Кибернетика ……….. Гуманитарные: Социология Филология Философия Экономика Этнография История …….. Математика: алгебра, геометрия, математический анализ

История развития естествознания Развитие естествознания непосредственно связано с потребностями общества. Движущая сила – развитие техники. Первый подготовительный период – натурфилософский. До 1го века н.э. Все естественнонаучные знания и воззрения входили в единую недифференцированную науку, находившуюся под эгидой философии. Натурфилософия - попытка истолковать и объяснить природу, основываясь на результатах, полученных научными методами, с целью найти ответы на некоторые философские вопросы. Занимается важнейшими естественнонаучными понятиями (субстанция, материя, сила, пространство, время, жизнь, развитие, закон природы), познанием связей и закономерностей явлений природы. Гераклит Эфесский, Фалес Милесский, Анаксимен, Анаксимандр, Пифагор, Демокрит, Эмпедокл, Платон, Аристотель, Евклид, Эпикур, Архимед.

Аристотель Платон Архимед

Аристотель (384 до н.э.) был первым ученым, создавшим всестороннюю систему философии, охватившей все сферы человеческого развития - социологию, науку, философию, политику, логику. Его взгляды на физическую сторону мира имели серьезное влияние на последующее развитие человеческой мысли. Концепции философа стали предтечей последующего бурного развития логики, механики, физики и всех смежных наук в постсредневековье, оказав влияние на всех заметных деятелей Эпохи Просвещения. Метафизическое учение Аристотеля было всецело принято схоластикой, сформировав мировоззренческую платформу этого учения. Метафизика — раздел философии, занимающийся исследованиями первоначальной природы реальности, бытия и мира как такового. В настоящее время термин также используется для обозначения предметов, находящихся за пределами физического мира, представляя собой учение о сверхчувственном, то есть лежащем за пределами физических явлений. В качестве примера можно привести устоявшееся словосочетание "метафизическая литература", то есть книги о "привидениях", "исцелении души", "оккультизме" и т.д.

Платон (428 г. до н.э.) Практически все известные сочинения Платона написаны в форме высокохудожественных диалогов. Платоновский корпус (Corpus Platonicum), то есть исторически сложившаяся совокупности сочинений, которые со времён античности связываются с именем Платона, формировался на протяжении долгого времени. Наиболее известным диалогом Платона является «Государство». Он описывает политическую утопию, противопоставляемую круговороту реальных государственных форм. Эти положения отталкиваются от общефилософских взглядов. По Платону существуют два мира: мир идей (эйдосов) и мир вещей. Любая вещь является лишь отражением своей идеи, может стремится к ней, но никогда не достигнет ее. Философ же и должен изучать идеи, а не сами вещи. Это относится и к государству, Платон описывает круговорот государственных форм, но все они не совершенны, хотя бы потому, что существуют в мире вещей, идеальная же форма им противостоит.

2. Второй подготовительный период – 1в. н.э. – XVв н.э. Господство схоластики и теологии 3. Период механического и метафизического естествознания – XV-XVII вв.н.э. Метафизика — раздел философии, занимающийся исследованиями первоначальной природы реальности, бытия и мира как такового. Так как господствующим методом мышления стала метафизика, этот период можно назвать метафизическим Естествознание было механическим, поскольку ко всем процессам природы прилагался исключительно масштаб механики.

Г.Галилей И. Ньютон Г. Лейбниц М.В.Ломоносов

Галилео Галилей (1564) - итальянский философ, математик, физик, механик и астроном, оказавший значительное влияние на науку своего времени. Галилей первым использовал телескоп для наблюдения планет и других небесных тел, и сделал ряд выдающихся астрономических открытий. Галилей — основатель экспериментальной физики. Своими экспериментами он убедительно опроверг умозрительную метафизику Аристотеля и заложил фундамент классической динамики. При жизни был известен как активный сторонник гелиоцентрической системы мира, что привело Галилея к серьёзному конфликту с католической церковью. Исаак Ньютон (1642 — 1727) — великий английский физик, математик и астроном. Автор фундаментального труда «Математические начала натуральной философии», в котором он описал закон всемирного тяготения и так называемые Законы Ньютона, заложившие основы классической механики. Разработал дифференциальное и интегральное исчисление, теорию цветности и многие другие математические и физические теории.

Готфрид Вильгельм фон Лейбниц 1646- 1716 - немецкий (саксонский) философ и математик. Лейбниц - один из важнейших представителей новоевропейской метафизики, в центре внимания которой - вопрос о том, что такое субстанция. Лейбниц развивает систему, получившую название субстанциальный плюрализм или монадология. Согласно Лейбницу, основаниями существующих явлений или феноменов служат простые субстанции или монады. Все монады просты и не содержат частей. Их бесконечно много. Каждая монада отличается от другой. Это обеспечивает бесконечное разнообразие мира феноменов. Важнейшие математические достижения Лейбница: Лейбниц, наряду с Ньютоном, создал математический анализ - дифференциальное и интегральное исчисление. Лейбниц создал комбинаторику как науку; только он во всей истории математики одинаково свободно работал как с непрерывным, так и с дискретным. В 1673 году, после знакомства с Христианом Гюйгенсом, Лейбниц создал механический калькулятор (арифмометр), выполняющий сложение, вычитание, умножение и деление чисел. Лейбниц подсказал Дени Папену конструкцию паровой машины (цилиндр и поршень).

4. Период открытия всеобщей связи и утверждения эволюционных идей в естествознании – XVIII-XIX вв Ч.Дарвин Ж.Б.Ламарк

Клеточная теория, учение о превращении энергии, дарвинизм. Теория химического строения органических соединений. (Бутлеров) Периодический закон и система химических элементов (Менделеев) Химическая термодинамика (Вант-Гофф) Электромагнитная теория света (Максвелл) 5. Современное естествознание. XX в - …. Теория относительности, квантовая механика и квантовая хромодинамика, генетика, молекулярная биология….

Понятие о материи, формы существования материи, формы движения материи Материя (филос.) – объективная реальность данная нам в ощущениях. Материя (физич.) - фундаментальное понятие, связанное с любыми объектами, существующими в природе, о которых мы можем судить благодаря нашим ощущениям Вещество – вид материи, состоящий из различных элементарных частиц. (адронное, барионное, антивещество, нейтронное вещество, кварк-глюонная плазма) Поле – совокупность физических полей различной природы (электромагнитное, гравитационное) Струны – докварковые сверхплотные образования. Сочетают свойства полей и вещественных объектов. Струноподобные объекты в современной физической теории претендуют на роль наиболее фундаментальных материальных образований, к которым можно свести все элементарные частицы, т.е. в конечном счёте, все известные формы материи.
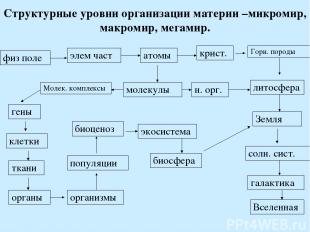
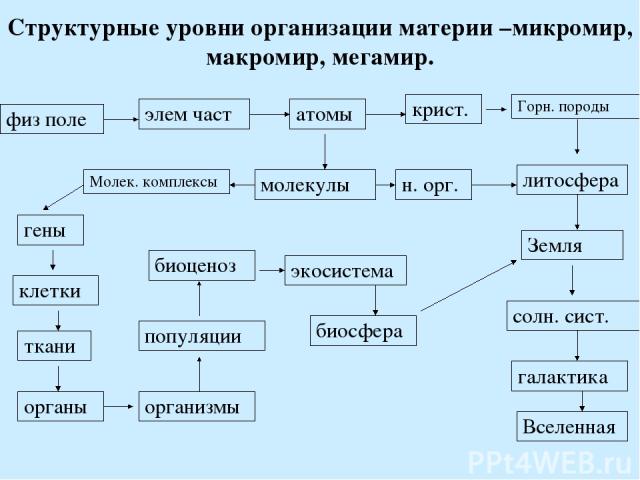
Структурные уровни организации материи –микромир, макромир, мегамир. физ поле элем част атомы крист. Горн. породы литосфера Земля солн. сист. галактика Вселенная молекулы н. орг. Молек. комплексы гены клетки ткани органы организмы популяции биоценоз экосистема биосфера

Процесс познания. Познание (философия) - совокупность процедур и методов приобретения знаний о явлениях и закономерностях объективного мира. Наблюдение Гипотеза – предположение о сущности явлений Теория – подтвердившаяся гипотеза. Теория должна: Исходить из небольшого числа фундаментальных положений Быть достаточно общей Быть точной Допускать усовершенствование Моделирование – воспроизведение существенных особенностей изучаемого явления или объекта

Индукция (греч. epagoge, лат. inductio — наведение), вид обобщений, связанных с предвосхищением результатов наблюдений и экспериментов на основе данных прошлого опыта, т.е это процесс логического вывода на основе перехода от частного положения к общему. Начинается И. обычно с анализа и сравнения данных наблюдения или эксперимента. По мере расширения множества данных, может выявиться регулярная повторяемость какого-либо свойства или отношения, что естественно приводит к индуктивному обобщению — предположению, что именно так будет обстоять дело во всех сходных случаях. Дедукция — (от лат. deductio — выведение), метод мышления, при котором новое положение выводится чисто логическим путем из предшествующих; цепь умозаключений, звенья которой связаны отношением логического следования. Началом (посылками) дедукции являются аксиомы, постулаты или просто гипотезы, имеющие характер общих утверждений («общее»), а концом — следствия, теоремы («частное»). Дедукция — основное средство доказательства. Противоположно индукции.

Химические концепции Изучаются химические формы движения материи (превращения веществ) Химия- наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакций. Предмет - химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. Химические – явления, при которых из одних веществ образуются другие.

Атомно-молекулярное учение Вещество - это форма материи, обладающая массой покоя и определенными физическими и химическими свойствами. Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Молекула – частица, состоящая из двух или более атомов, которая может самостоятельно существовать, это наименьшая частица вещества, обладающая всеми его химическими свойствами Атом - наименьшая частица химического элемента, обладающая всеми его свойствами. Атом - предел химического разложения любого вещества. Простое вещество (если оно не является одноатомным, как, например, гелий, водород, сера) - разлагается на атомы одного вида. Сложное вещество - на атомы разных видов. Химический элемент - это вид атомов с определенным положительным зарядом ядра.

Стехиометрические законы Закон сохранения массы - масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. (Ломоносов М.В. 1748 г.) Закон постоянства состава - любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношение их масс постоянны, а относительные числа их атомов выражаются целыми числами (Пруст Ж.Л., 1808г) Закон кратных отношений – Если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой, как небольшие целые числа. (1803 Дж.Дальтон) CO – угарный газ O:C=16/12=1,33 CO2 – углекислый газ O:C=32/12=2,66 2,66/1,33=2

4. Закон простых объемных отношений - при равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа (Гей-Люссак, 1808г). 5. Закон Авогадро - В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (1811г) Из закона Авогадро вытекают два следствия: Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем. Относительная плотность одного газа по другому равна отношению их молярных масс.

Число Авогадро – число частиц в моле любого вещества; NA=6,02∙1023 моль–1. Моль - единица измерения количества вещества в СИ. Соответствует количеству вещества, содержащему столько структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 0,012 кг изотопа 12C Молярный объем – объем моля любого газа при нормальных условиях; равен 22,4 л∙моль–1. Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль–1. 6. Закон эквивалентов - в молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты. (Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам)

Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях. Эквивалент вещества Эквивалент элемента

Атомные и молекулярные массы. Моль Абсолютная масса – масса, выраженная в абсолютных единицах массы (гамм, килограмм …) Относительная масса – масса выраженная в атомных единицах массы Атомная масса – масса атома. Молекулярная масса – масса молекулы. Для единицы измерения относительной атомной/молекулярной массы используют 1/12 массы изотопа углерода 12С.

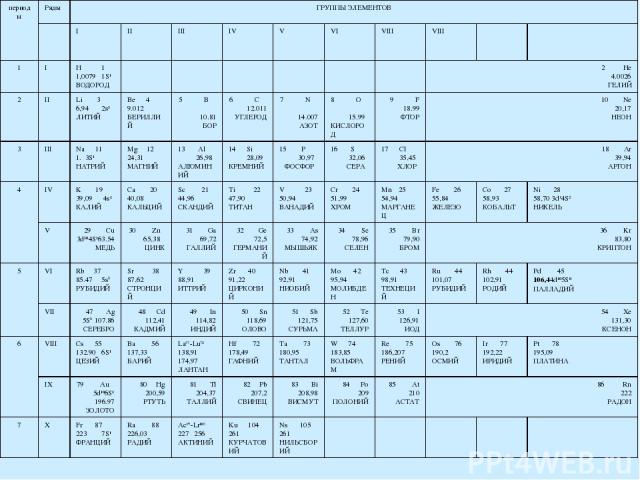
Периодический закон и периодическая система 1869г. Менделеев Д.И. Закон: свойства элементов и образуемых ими простых и сложных веществ, стоят в периодической зависимости от их атомного веса (заряда ядра). Следствие периодического закона – периодическая система элементов. Вертикальные столбцы – группы Горизонтальные строки - периоды Две формы таблицы: компактная и широкая:
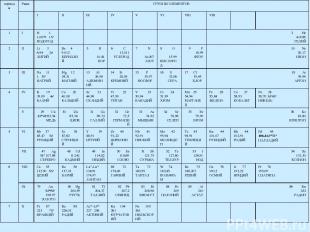
периоды Ряды ГРУППЫ ЭЛЕМЕНТОВ I II III IV V VI VIII VIII 1 I H 1 1,0079 1S1 ВОДОРОД 2 He 4.0026 ГЕЛИЙ 2 II Li 3 6,94 2s1 ЛИТИЙ Be 4 9.012 БЕРИЛЛИЙ 5 B 10.81 БОР 6 C 12.011 УГЛЕРОД 7 N 14.007 АЗОТ 8 O 15.99 КИСЛОРОД 9 F 18.99 ФТОР 10 Ne 20,17 НЕОН 3 III Na 11 3S1 НАТРИЙ Mg 12 24,31 МАГНИЙ 13 Al 26,98 АЛЮМИНИЙ 14 Si 28,09 КРЕМНИЙ 15 P 30,97 ФОСФОР 16 S 32,06 СЕРА 17 Cl 35,45 ХЛОР 18 Ar 39,94 АРГОН 4 IV K 19 39,09 4s1 КАЛИЙ Ca 20 40,08 КАЛЬЦИЙ Sc 21 44,96 СКАНДИЙ Ti 22 47,90 ТИТАН V 23 50,94 ВАНАДИЙ Cr 24 51,99 ХРОМ Mn 25 54,94 МАРГАНЕЦ Fe 26 55,84 ЖЕЛЕЗО Co 27 58,93 КОБАЛЬТ Ni 28 58,70 3d84S2 НИКЕЛЬ V 29 Cu 3d104S163.54 МЕДЬ 30 Zn 65,38 ЦИНК 31 Ga 69,72 ГАЛЛИЙ 32 Ge 72,5 ГЕРМАНИЙ 33 As 74,92 МЫШЬЯК 34 Se 78,96 СЕЛЕН 35 Br 79,90 БРОМ 36 Kr 83,80 КРИПТОН 5 VI Rb 37 85.47 5s1 РУБИДИЙ Sr 38 87,62 СТРОНЦИЙ Y 39 88,91 ИТТРИЙ Zr 40 91,22 ЦИРКОНИЙ Nb 41 92,91 НИОБИЙ Mo 42 95,94 МОЛИБДЕН Tc 43 98,91 ТЕХНЕЦИЙ Ru 44 101,07 РУБИДИЙ Rh 44 102,91 РОДИЙ Pd 45 106,44d105S0 ПАЛЛАДИЙ VII 47 Ag 5S1 107.86 СЕРЕБРО 48 Cd 112,41 КАДМИЙ 49 In 114,82 ИНДИЙ 50 Sn 118,69 ОЛОВО 51 Sb 121,75 СУРЬМА 52 Te 127,60 ТЕЛЛУР 53 I 126,91 ИОД 54 Xe 131,30 КСЕНОН 6 VIII Cs 55 132.90 6S1 ЦЕЗИЙ Ba 56 137,33 БАРИЙ La57-Lu71 138,91 174,97 ЛАНТАН Hf 72 178,49 ГАФНИЙ Ta 73 180,95 ТАНТАЛ W 74 183,85 ВОЛЬФРАМ Re 75 186,207 РЕНИЙ Os 76 190,2 ОСМИЙ Ir 77 192,22 ИРИДИЙ Pt 78 195,09 ПЛАТИНА IX 79 Au 5d106S1 196.97 ЗОЛОТО 80 Hg 200,59 РТУТЬ 81 Tl 204,37 ТАЛЛИЙ 82 Pb 207,2 СВИНЕЦ 83 Bi 208,98 ВИСМУТ 84 Po 209 ПОЛОНИЙ 85 At 210 АСТАТ 86 Rn 222 РАДОН 7 X Fr 87 223 7S1 ФРАНЦИЙ Ra 88 226,03 РАДИЙ Ac89-Lr103 227 256 АКТИНИЙ Ku 104 261 КУРЧАТОВИЙ Ns 105 261 НИЛЬСБОРИЙ

Строение атома 1897г открытие электрона (Дж.Томсон). В центре массивное ядро, состоящее из протонов и нейтронов. Вокруг ядра находятся электроны.

Размеры атомов порядка 10–10–10–9 м. Размеры ядра в 100 000 раз меньше (10–15–10–14 м). Заряд электрона 1,6х10-19 кл. Заряд ядра соответствует порядковому номеру элемента в периодической системе, сл-но число электронов в атоме соответствует порядковому номеру элемента в п.с. Квантовая теория Бора. Постулаты 1. Электрон в атоме может находиться только на определенных (стационарных) орбитах 2. Двигаясь по орбите электрон не излучает электромагнитную энергию 3. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую Теория Бора основана на механике классических частиц с дополнением в виде квантовых постулатов
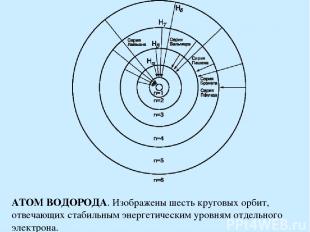
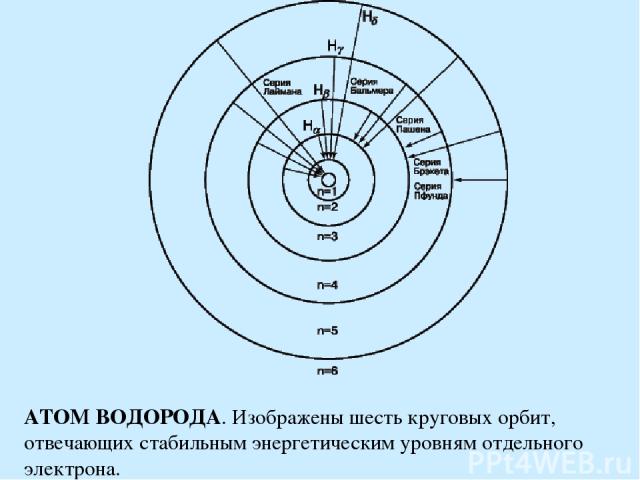
АТОМ ВОДОРОДА. Изображены шесть круговых орбит, отвечающих стабильным энергетическим уровням отдельного электрона.

Строение атома в квантовой механике Всем элементарным частицам присущ корпускулярно-волновой дуализм Е – энергия волны h – постоянная Планка, 6,62х10-34 Дж·с λ – длина эл-маг волны - ур-е Де Бройля Электрон рассматривается как электронное облако – область вблизи ядра атома, где сосредоточена большая часть массы электрона.

Квантовые числа электрона в атоме При решении волнового уравнения Шрёдингера для атома водорода возникают три квантовых числа, обычно обозначаемые символами n, l и m Главное квантовое число: n. Определяет возможные энергетические состояния электрона в атоме. Значения 1,2.3….. Радиус орбиты электрона: a – радиус первой Боровской орбиты 5,29·10-11м Энергетический уровень – совокупность электронов с одинаковым значением n. 1 2 3 4 5 6 7 K L M N O P Q

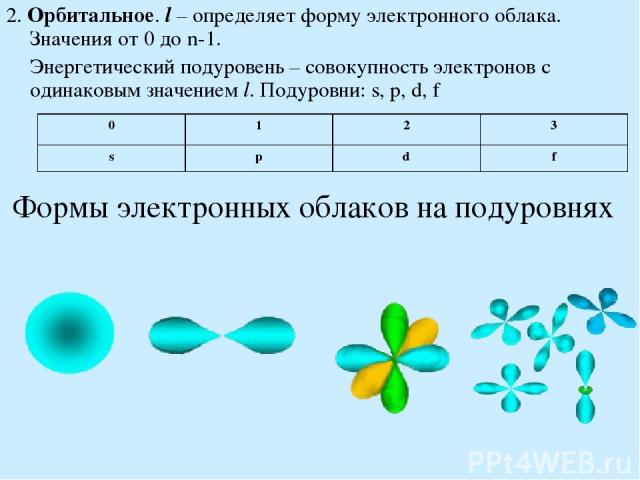
Формы электронных облаков на подуровнях 2. Орбитальное. l – определяет форму электронного облака. Значения от 0 до n-1. Энергетический подуровень – совокупность электронов с одинаковым значением l. Подуровни: s, p, d, f 0 1 2 3 s p d f
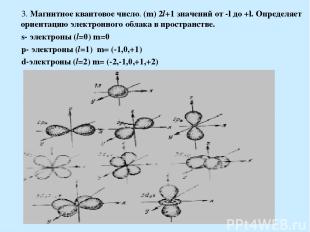
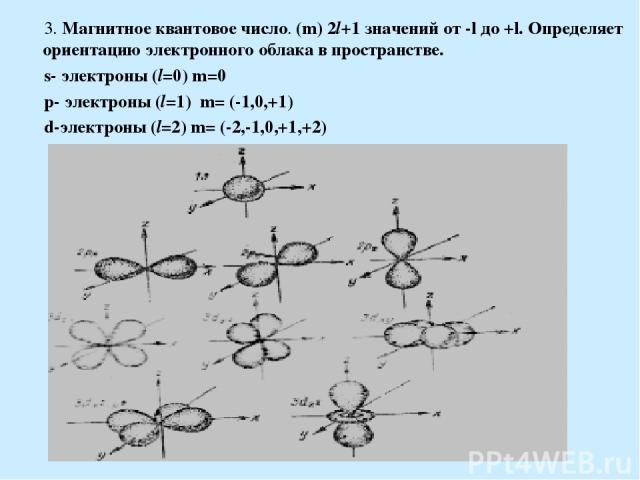
3. Магнитное квантовое число. (m) 2l+1 значений от -l до +l. Определяет ориентацию электронного облака в пространстве. s- электроны (l=0) m=0 p- электроны (l=1) m= (-1,0,+1) d-электроны (l=2) m= (-2,-1,0,+1,+2)

электрон имеет собственный момент импульса, или спин, т.е. его можно представить себе вращающимся вокруг собственной оси одновременно с вращением по орбите вокруг ядра. 4. спиновое квантовое число (S): +1/2 или -1/2 Принцип Паули: в каждом отдельном квантовом состоянии может находиться только один электрон. Квантовое – состояние характеризующееся 4-мя квантовыми числами. Максимальное число электронов в подоболочке (подуровне) равно 2(2l + 1), а максимальное число подоболочек составляет n. Для каждого n полностью заполненная оболочка содержит 2n2 электронов. Атомная электронная орбиталь – состояние, характеризующееся опр. значением n, m, l. Обозначается
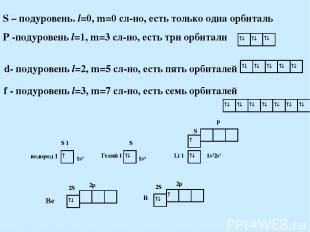
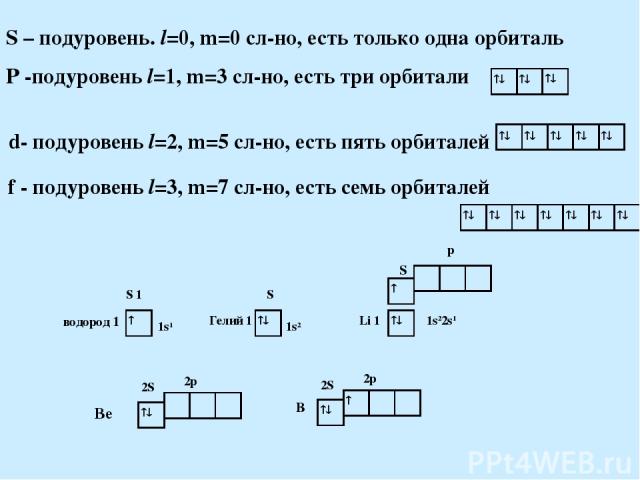
S – подуровень. l=0, m=0 сл-но, есть только одна орбиталь
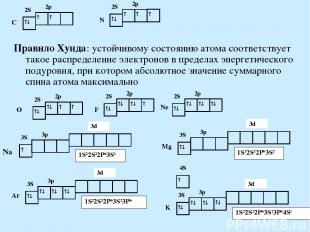
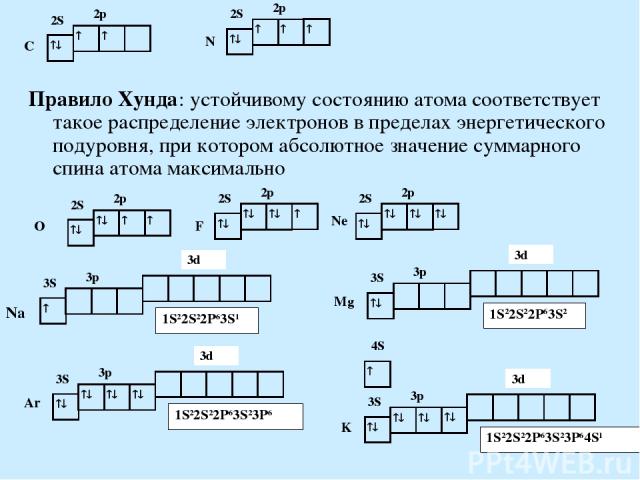
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально

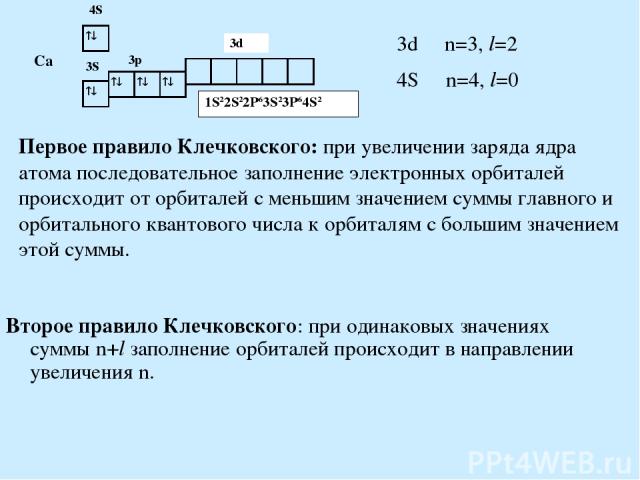
Первое правило Клечковского: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантового числа к орбиталям с большим значением этой суммы. Второе правило Клечковского: при одинаковых значениях суммы n+l заполнение орбиталей происходит в направлении увеличения n.
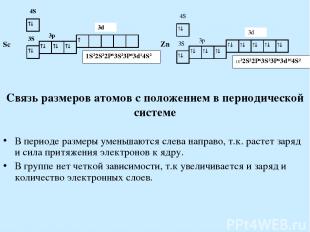
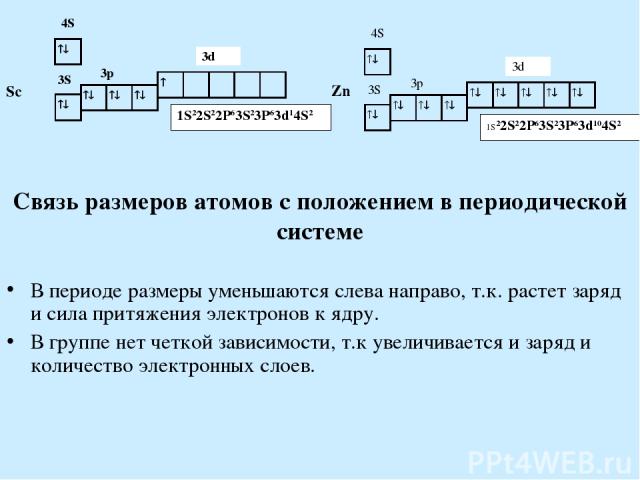
Связь размеров атомов с положением в периодической системе В периоде размеры уменьшаются слева направо, т.к. растет заряд и сила притяжения электронов к ядру. В группе нет четкой зависимости, т.к увеличивается и заряд и количество электронных слоев.
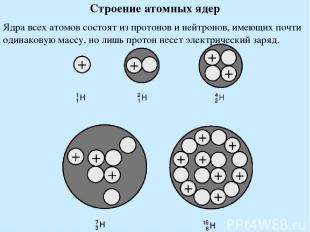
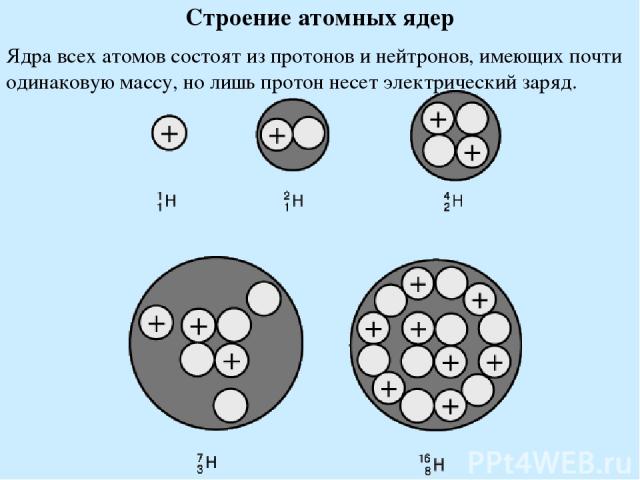
Строение атомных ядер Ядра всех атомов состоят из протонов и нейтронов, имеющих почти одинаковую массу, но лишь протон несет электрический заряд.

Нейтрон на 0,1% тяжелее протона. Свободные нейтроны (вне ядра) претерпевают радиоактивный распад, превращаясь в протон и электрон. Протон (P) имеет массу 1,00728 а.е.м, заряд +1 Нейтрон (n) имеет массу 1,00867 а.е.м, заряд 0 Число протонов = заряд ядра = порядковый номер элемента Число нейтронов = масса атома - порядковый номер элемента Протоны и нейтроны = нуклоны. Нуклоны удерживаются в ядре ядерными силами (короткодействующие, сильные взаимодействия). Дефект масс – масса ядра меньше чем масса нуклонов, из которых оно составлено. Энергия связи ядра - энергия, выделяющаяся при его образовании из нуклонов. Изотопы – атомы, обладающие одинаковым зарядом ядра, но разным числом нейтронов.
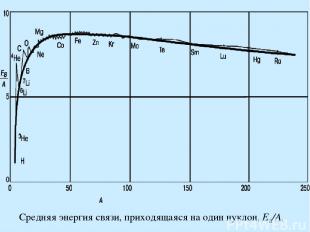
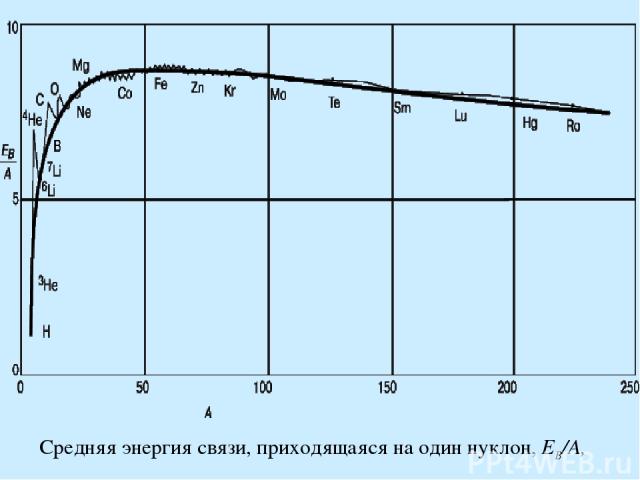
Средняя энергия связи, приходящаяся на один нуклон, EB/A,

Элементарные частицы Адроны – составные частицы Лептоны - фундаментальные участвуют в сильном взаимодействии (наряду с электромагнитным и слабым). участвуют только в электромагнитном и слабом взаимодействии мезоны (адроны с целым спином, т. е. бозоны); барионы (адроны с полуцелым спином, т. е. фермионы). К ним, в частности, относятся частицы, составляющие ядро атома, - протон и нейтрон. Электроны мюоны, тау-лептоны Нейтрино (электронное, мюонное, тау-нейтрино).

Калибровочные бозоны – фундаментальные частицы Это частицы, посредством обмена которыми осуществляются взаимодействия: фотон - частица, переносящая электромагнитное взаимодействие; восемь глюонов - частиц, переносящих сильное взаимодействие; три промежуточных векторных бозона W+, W− и Z0, переносящие слабое взаимодействие; гравитон - гипотетическая частица, переносящая гравитационное взаимодействие. Существование гравитонов, хотя пока не доказано экспериментально, но считается вполне вероятным. Адроны и лептоны образуют вещество. Калибровочные бозоны - это кванты разных видов излучения. самыми элементарными, точечными частями вещества сейчас считаются лептоны и кварки

Кварковая гипотеза материи Гипотеза М.Гелл-Манна и Д.Цвейга (1964 г): вся видимая материя во Вселенной – на Земле и в космосе – состоит из фундаментальных частиц трех разных видов: электронов и двух типов кварков Верхний кварк (U-кварк)= +2/3ē Нижний кварк (d-кварк) = -1/3ē Протон: P=UUd Нейтрон: n=Udd

Современные представления о кварках

адроны состоят из кварков, а силы между кварками обусловлены обменом глюонами. Все обнаруженные адроны состоят из кварков пяти различных типов ("ароматов"). Кварк каждого "аромата" может находиться в трех "цветовых" состояниях, или обладать тремя различными "цветовыми зарядами" Квантовая хромодинамика Цветовой заряд – силы взаимодействия между кварками. Термин «цвет» взят из оптики: три основных цвета при смешении дают белый (нейтрализация цветового заряда) Обычная материя образуется из электронов и кварков, группирующихся в объекты, нейтральные по цветовому, а затем и по электрическому заряду.
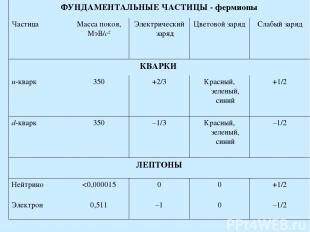
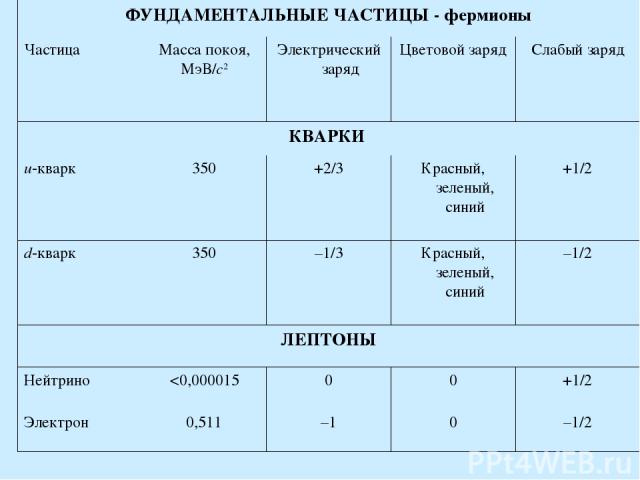
ФУНДАМЕНТАЛЬНЫЕ ЧАСТИЦЫ - фермионы Частица Масса покоя, МэВ/с2 Электрический заряд Цветовой заряд Слабый заряд КВАРКИ u-кварк 350 +2/3 Красный, зеленый, синий +1/2 d-кварк 350 –1/3 Красный, зеленый, синий –1/2 ЛЕПТОНЫ Нейтрино
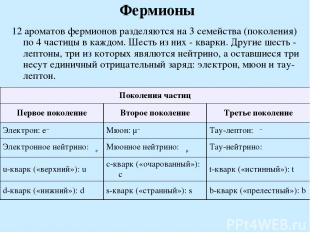
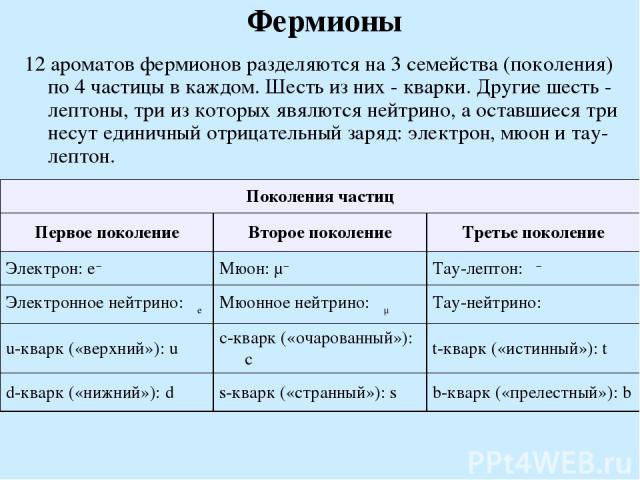
Фермионы 12 ароматов фермионов разделяются на 3 семейства (поколения) по 4 частицы в каждом. Шесть из них - кварки. Другие шесть - лептоны, три из которых явялются нейтрино, а оставшиеся три несут единичный отрицательный заряд: электрон, мюон и тау-лептон. Поколения частиц Первое поколение Второе поколение Третье поколение Электрон: e− Мюон: μ− Тау-лептон: τ− Электронное нейтрино: νe Мюонное нейтрино: νμ Тау-нейтрино: ντ u-кварк («верхний»): u c-кварк («очарованный»): c t-кварк («истинный»): t d-кварк («нижний»): d s-кварк («странный»): s b-кварк («прелестный»): b

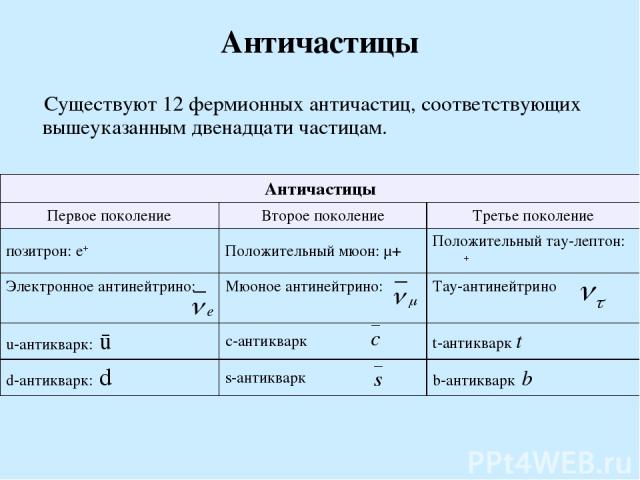
Античастицы Существуют 12 фермионных античастиц, соответствующих вышеуказанным двенадцати частицам. Античастицы Первое поколение Второе поколение Третье поколение позитрон: e+ Положительный мюон: μ+ Положительный тау-лептон: τ+ Электронное антинейтрино: Мюоное антинейтрино: Тау-антинейтрино u-антикварк: ū c-антикварк t-антикварк t d-антикварк: d s-антикварк b-антикварк b

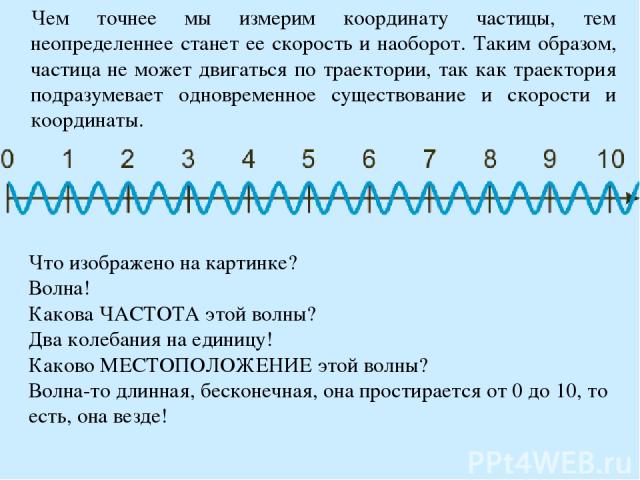
Принцип неопределенности Гейзенберга В квантовой физике так называют закон, который устанавливает ограничение на точность (почти)одновременного измерения переменных состояния, например, положения и импульса частицы. Принцип неопределённости в квантовой механике иногда объясняется таким образом, что измерение координаты обязательно влияет на импульс частицы Отношения неопределенности Гейзенберга - это теоретический предел точности любых измерений. Существует точная, количественная аналогия между отношениями неопределённости Гейзенберга и свойствами волн или сигналов. Рассмотрим переменный во времени сигнал, например звуковую волну. Бессмысленно говорить о частотном спектре сигнала в какой-либо момент времени. Для точного определения частоты необходимо наблюдать за сигналом в течение некоторого времени, таким образом теряя точность определения времени. Другими словами, звук не может иметь и точного значения времени, как например короткий импульс, и точного значения частоты, как, например, в непрерывном чистом тоне. Временно е положение и частота волны во времени походят на координату и импульс частицы в пространстве.

Чем точнее мы измерим координату частицы, тем неопределеннее станет ее скорость и наоборот. Таким образом, частица не может двигаться по траектории, так как траектория подразумевает одновременное существование и скорости и координаты. Что изображено на картинке? Волна! Какова ЧАСТОТА этой волны? Два колебания на единицу! Каково МЕСТОПОЛОЖЕНИЕ этой волны? Волна-то длинная, бесконечная, она простирается от 0 до 10, то есть, она везде!
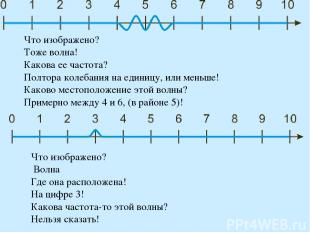
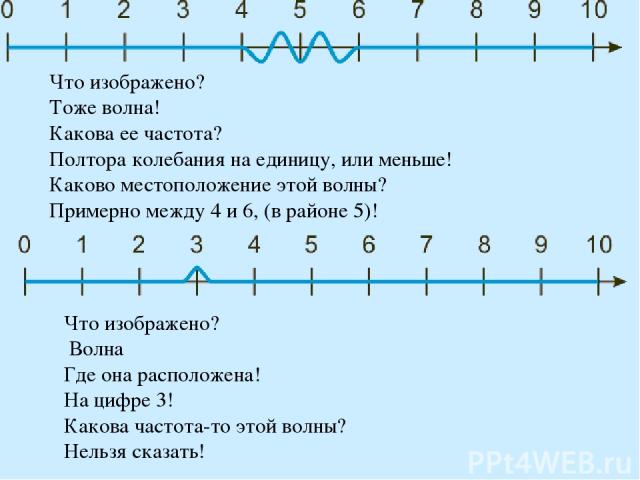
Что изображено? Тоже волна! Какова ее частота? Полтора колебания на единицу, или меньше! Каково местоположение этой волны? Примерно между 4 и 6, (в районе 5)! Что изображено? Волна Где она расположена! На цифре 3! Какова частота-то этой волны? Нельзя сказать!

Химическая связь и строение молекул Теория строения хим. Соединений по Бутлерову Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию новых веществ. Соединение атомов происходит в соответствии с валентностью Свойства веществ зависят не только от их состава, но и от их хим. строения. Значение теории Бутлерова Возможность определения строения молекул по данных об их химических свойствах и наоборот. Систематизация веществ Разработка технологий синтеза химических соединений
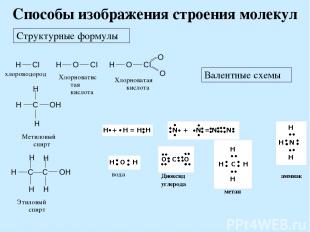
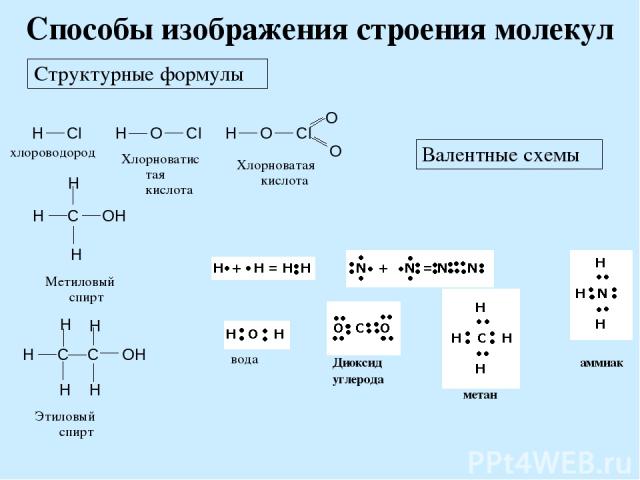
Способы изображения строения молекул Структурные формулы Валентные схемы
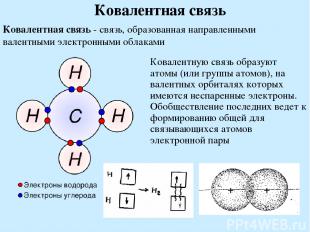
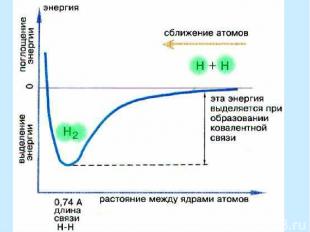
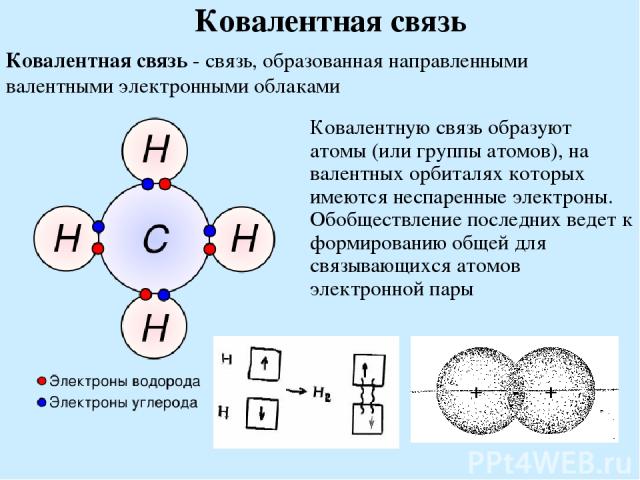
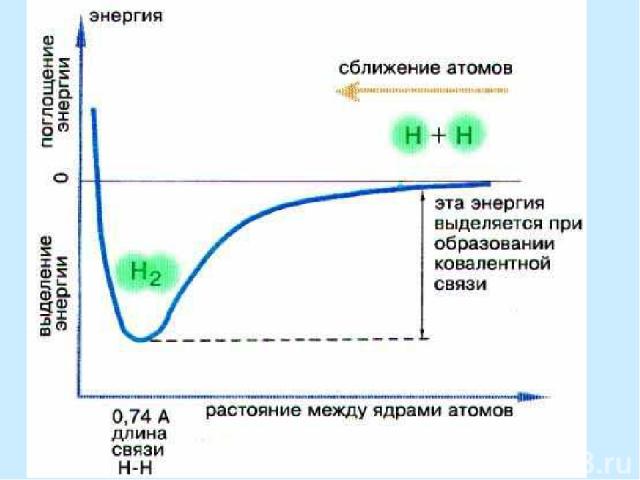
Ковалентная связь Ковалентная связь - связь, образованная направленными валентными электронными облаками Ковалентную связь образуют атомы (или группы атомов), на валентных орбиталях которых имеются неспаренные электроны. Обобществление последних ведет к формированию общей для связывающихся атомов электронной пары
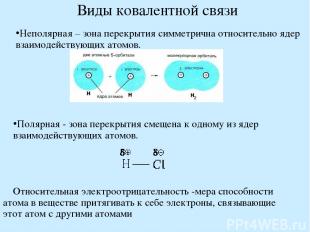
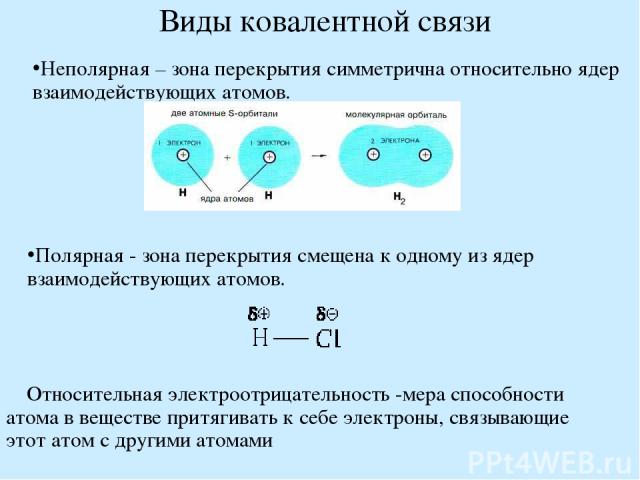
Виды ковалентной связи Неполярная – зона перекрытия симметрична относительно ядер взаимодействующих атомов. Полярная - зона перекрытия смещена к одному из ядер взаимодействующих атомов. Относительная электроотрицательность -мера способности атома в веществе притягивать к себе электроны, связывающие этот атом с другими атомами
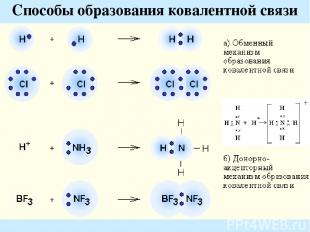
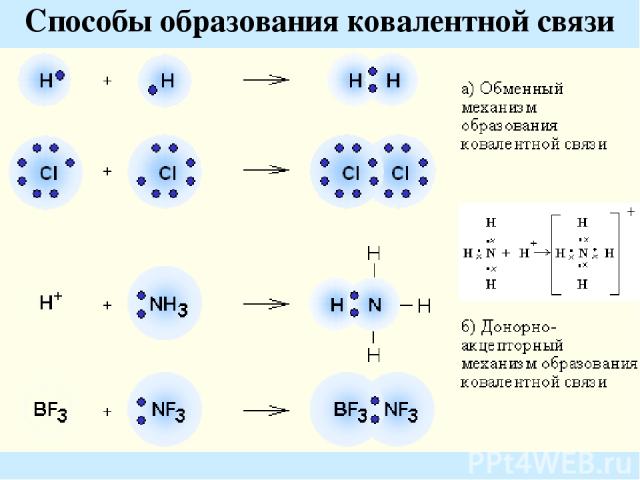
Способы образования ковалентной связи
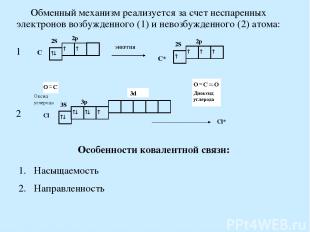
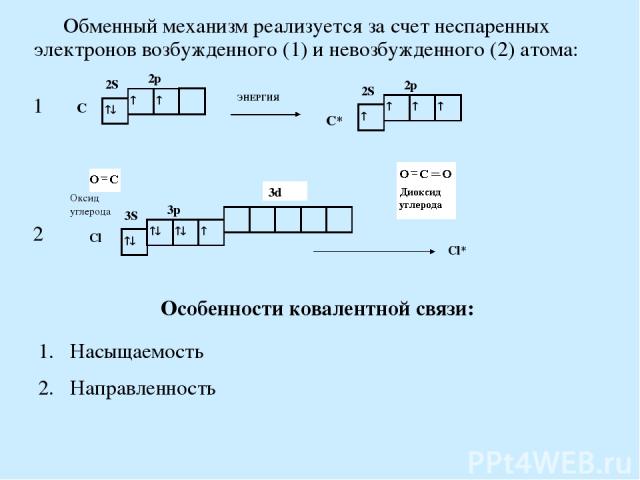
Обменный механизм реализуется за счет неспаренных электронов возбужденного (1) и невозбужденного (2) атома: Особенности ковалентной связи: Насыщаемость Направленность
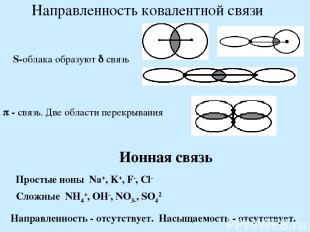
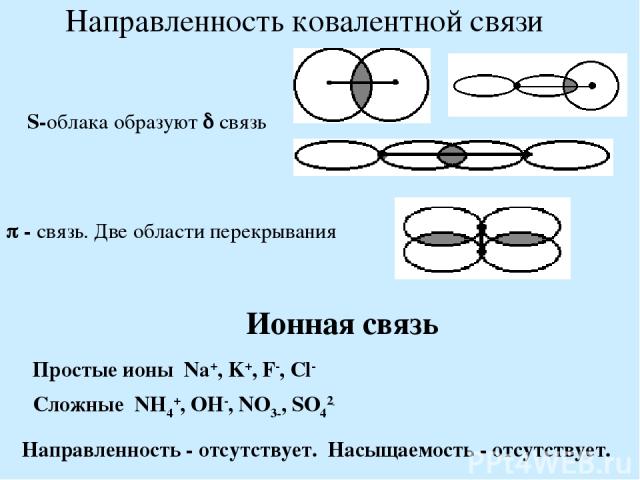
Направленность ковалентной связи S-облака образуют связь - связь. Две области перекрывания Ионная связь Простые ионы Na+, K+, F-, Cl- Сложные NH4+, OH-, NO3-, SO42- Направленность - отсутствует. Насыщаемость - отсутствует.

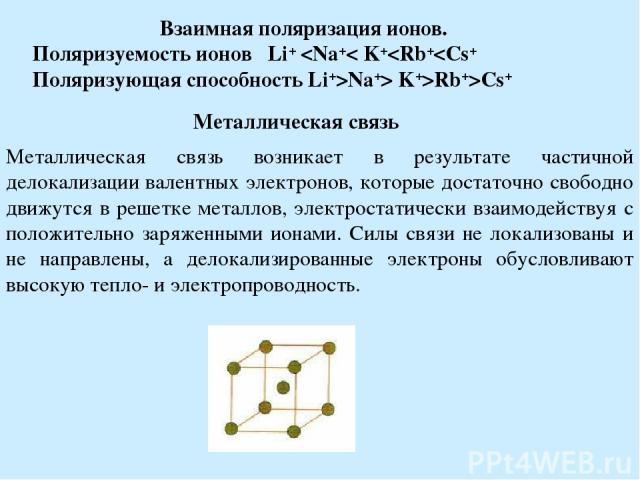
Взаимная поляризация ионов. Поляризуемость ионов Li+ Rb+>Cs+ Металлическая связь Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
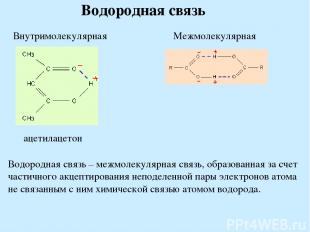
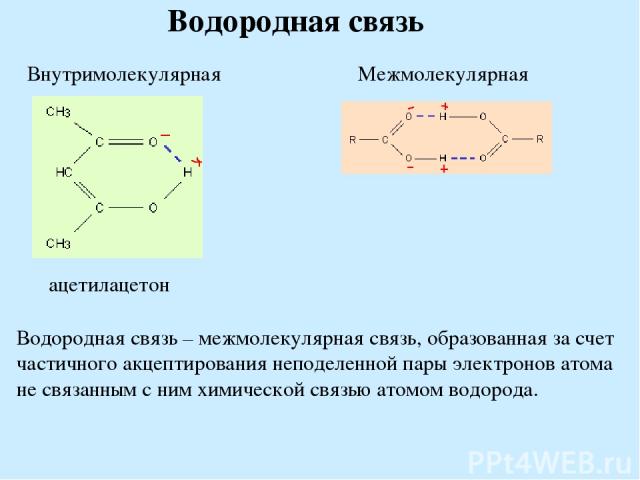
Водородная связь Водородная связь – межмолекулярная связь, образованная за счет частичного акцептирования неподеленной пары электронов атома не связанным с ним химической связью атомом водорода.

Химическая термодинамика Энергетика химических процессов. Термодинамика – это наука о тепловых явлениях. Внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. Внутренняя энергия является функцией состояния. Тепловой эффект реакции – количество теплоты, выделяющееся или поглощающееся в ходе химической реакции. Экзотермическая Эндотермическая

В термодинамике используют следующие термодинамические величины: Энтропия (S)- определяет меру необратимого рассеивания энергии. В статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; Больцман постулировал, что: где константу k=1,38•10–23 Дж/К мы знаем теперь как постоянную Больцмана, а Ω является числом микросостояний, которые возможны в имеющемся макроскопическом состоянии (статистический вес состояния). Принцип Больцмана связывает микроскопические свойства системы (Ω) с одним из её термодинамических свойств (S). Согласно определению Больцмана, энтропия является просто функцией состояния. Так как Ω может быть только натуральным числом (1,2,3,…), то энтропия Больцмана должна быть положительной — исходя из свойств логарифма.

. В теории информации энтропия - мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы и т.д. Термодинамическая энтропия - функция состояния термодинамической системы, равная в равновесном процессе кол-ву теплоты сообщенной системе или отведенной от системы. Предел величины энтропии равновесной системы при стремлении температуры к абсолютному нулю полагают равным нулю. Существует мнение, что мы можем смотреть на Ω и как на меру беспорядка в системе. Рассмотрим, например, распределение молекул идеального газа. В случае идеального газа наиболее вероятным состоянием, соответствующим максимуму энтропии, будет равномерное распределение молекул. При этом реализуется и максимальный "беспорядок", т.к. при этом будут максимальные возможности конфигурирования.

Энергия Гиббса (изобарно-изотермический потенциал свободная энтальпия) - один из потенциалов термодинамических системы. Обозначается G, определяется разностью между энтальпией H и произведением энтропии S на термодинамическую температуру Т: G = H - T·S. Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса до достижения ее минимума, которому отвечает термодинамическое равновесное состояние системы. Энтальпия (H) – это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это общее количество доступной энергии вещества, которое можно преобразовать в теплоту.

Химическая кинетика Химическая система – вещество или совокупность веществ физически ограниченные от окружающей среды Гомогенная система – система, состоящая из 1й фазы Гетерогенная система - … Фаза – часть системы, отделенная от др. частей поверхностью раздела, при переходе через которую свойства меняются скачком. В гомогенной системе реакция идет во всем объеме системы: H2SO4+Na2S2O3=Na2SO4+H2O+SO2 + S В гетерогенной системе реакция идет только на поверхности раздела фаз: Fe+2HCl=FeCl2+H2 Скорость гомогенной реакции - кол-во вещества, вступающего в реакцию или образующегося в ходе реакции за единицу времени в единице объема системы:

Скорость гетерогенной реакции - кол-во вещества, вступающего в реакцию или образующегося в ходе реакции за единицу времени на единице поверхности фазы: Факторы, влияющие на скорость химической реакции: Природа реагирующих веществ Концентрация реагирующих веществ Температура Катализаторы Зависимость скорости реакции от концентраций реагирующих веществ Реакция происходит при соударении частиц. Чем выше концентрация, тем больше частиц. Чем больше частиц, тем больше соударений, тем выше скорость реакции. A+B=C V=k[A][B] k - константа скорости реакции
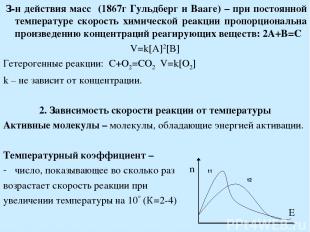
З-н действия масс (1867г Гульдберг и Вааге) – при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ: 2A+B=C V=k[A]2[B] Гетерогенные реакции: C+O2=CO2 V=k[O2] k – не зависит от концентрации. 2. Зависимость скорости реакции от температуры Активные молекулы – молекулы, обладающие энергией активации. Температурный коэффициент – число, показывающее во сколько раз возрастает скорость реакции при увеличении температуры на 10 (К=2-4)

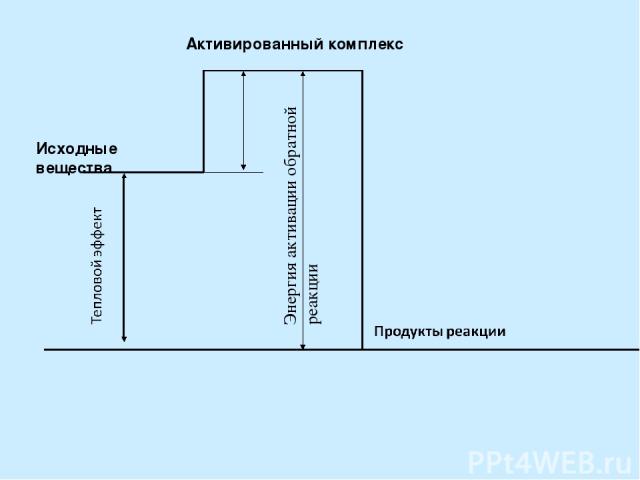
Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение привело к химической реакции. [кДж/моль]. Энергия активации зависит от природы реагирующих веществ. Активированный комплекс – неустойчивое промежуточное состояние вещества, характеризующееся большим запасом энергии. Энергия активации, кДж/моль Скорость реакции Примеры 120 Очень мала N2+H2=2NH3
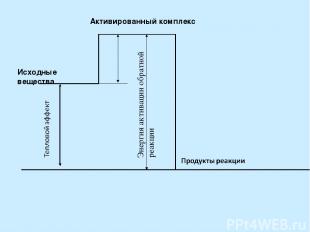
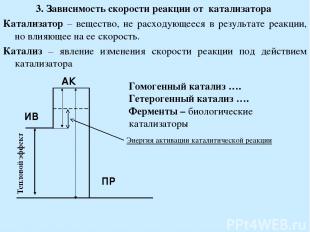
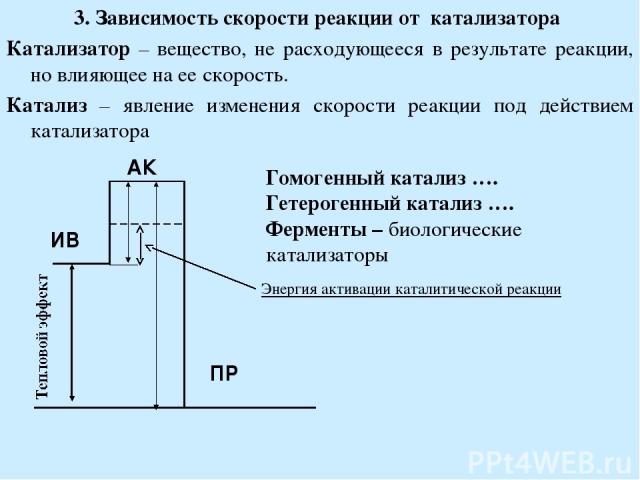
3. Зависимость скорости реакции от катализатора Катализатор – вещество, не расходующееся в результате реакции, но влияющее на ее скорость. Катализ – явление изменения скорости реакции под действием катализатора Гомогенный катализ …. Гетерогенный катализ …. Ферменты – биологические катализаторы Энергия активации каталитической реакции

Ферменты Ферменты или энзимы - белковые молекулы или их комплексы, ускоряющие химические реакции в живых системах. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза - фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название.

КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза По типу катализируемых реакций ферменты подразделяются на 6 классов
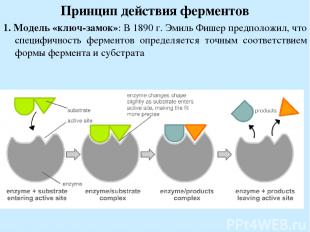
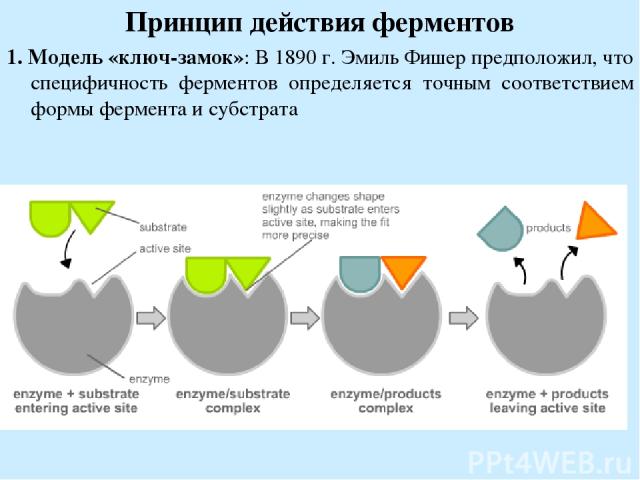
Принцип действия ферментов 1. Модель «ключ-замок»: В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата
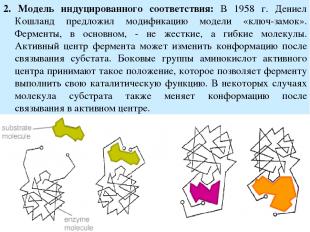
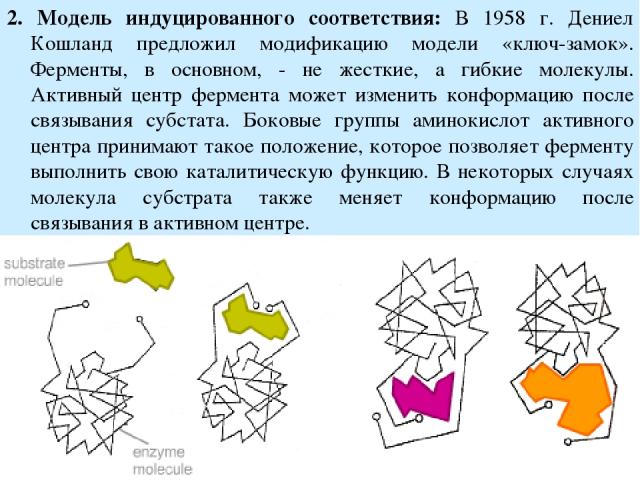
2. Модель индуцированного соответствия: В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, - не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре.

Кофакторы ферментов Есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами. Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.

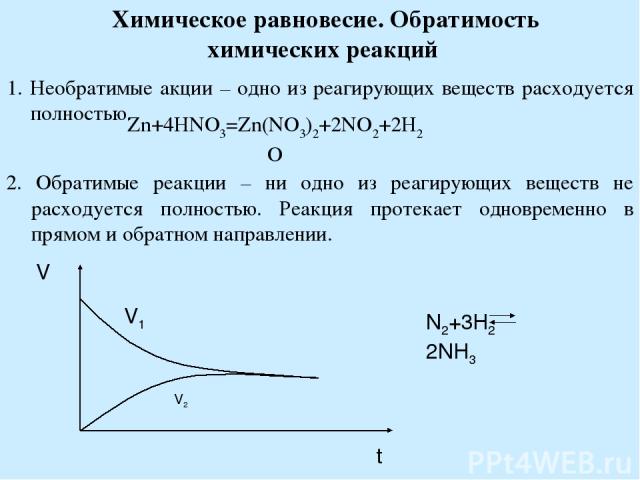
Химическое равновесие. Обратимость химических реакций 1. Необратимые акции – одно из реагирующих веществ расходуется полностью. Zn+4HNO3=Zn(NO3)2+2NO2+2H2O 2. Обратимые реакции – ни одно из реагирующих веществ не расходуется полностью. Реакция протекает одновременно в прямом и обратном направлении.

Химическое равновесие – состояние системы, при котором скорость прямой реакции равняется скорости обратной Константа химического равновесия V1 H2+J2 2HJ V2 V1=k1[H2][I2] V2=k2[HI]2 При гетерогенной реакции в расчет К входят только те вещества, которые находятся в жидком и газообразном состоянии. К зависит от природы реагирующих веществ и от температуры.

Смещение химического равновесия Нарушение равновесия из-за изменения концентраций реагирующих веществ При увеличении концентрации какого-либо вещества равновесие смещается в сторону расхода этого вещества. Принцип Ле-Шателье - Брауна (1884 г.) - если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение. 2. Нарушение равновесия при изменении давления Возможно, если в реакции участвуют газы. Если реакция идет без изменения объема, то изменение давления не приводит к смещению химического равновесия

3. Нарушение равновесия при изменении температуры При увеличении температуры равновесие смещается в сторону эндотермической реакции и наоборот. Растворы и их природа Растворитель – компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Если оба компонента находятся в одном агрегатном состоянии, то растворителем считается преобладающий по массе компонент. Раствор отличается от химического соединения тем, что его состав может изменяться в широких пределах и отдельные компоненты проявляют свои свойства самостоятельно.

Растворимость Смесь отличается от раствора тем, что раствор однороден, а смесь – нет. Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. Коэффициент растворимости – число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя. Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества. Пересыщенный раствор – раствор, в котором концентрация растворенного вещества превышает предел его растворимости при данной температуре. Такой раствор обычно неустойчив - при введении "затравки" (кристаллика вещества) избыточное количество растворяемого вещества выпадает в осадок, и раствор становится насыщенным.

Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество малорастворимо. Вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшая часть молекул стекла неизбежно переходит в раствор.

Процесс растворения Растворение твердых тел - гетерогенное физико-химическое взаимодействие твердого тела и жидкости, сопровождающееся переходом твердой фазы в раствор. Различают физическое, химическое и электрохимическое растворение. При физическом растворении переход в раствор в-ва не сопровождается изменением его хим. состава. При химическом растворении переход в-ва в раствор сопровождается хим. р-цией; исходное в-во нельзя выделить из раствора в твердом состоянии физ. методами (примеры - растворение металлов или их оксидов в кислотах. Электрохимическое растворение протекает в условиях, когда процессу сопутствует перенос электрических зарядов. Растворение сопровождается поглощением или выделением теплоты. 1. Твердые тела

Если на разрушение кристаллической решетки тратится больше энергии, чем образуется при получении гидратов, то раствор может охлаждаться. Например, если в стакан с водой поместить твердый нитрат аммония NH4NO3 и поставить стакан на влажный картон, то картон примерзает к стакану – настолько низко падает температура раствора. При некоторой концентрации, называемой концентрацией насыщения (Сн), между твердым телом и жидкостью устанавливается равновесие. При нем химический потенциал в-ва в р-ре становится равным химическому потенциалу того же в-ва в твердом состоянии. Концентрация Сн не зависит от давления, однако в значит. степени определяется температурой, с увеличением которой растворимость возрастает.

Физическое растворение может протекать по диффузионному, кинетическому или смешанному механизму. При диффузном механизме на поверхности растворяющегося тела возникает диффузионный пограничный слой, в пределах которого концентрация изменяется от Cн на поверхности тела до концентрации С в основной массе р-ра. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей ее и тела в слое и вне его (естественная конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость которого снижается по мере приближения к поверхности тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамических параметров и уменьшается с увеличением числа Рейнольдса Re=ud/v (u-скорость обтекания жидкостью объекта растворения, d-eгo размер, v-кинематическая вязкость жидкости).

Основной закон кинетики диффузионного растворения: dM/dt = kF(Сн - С), где М-масса растворяющегося в-ва, t-время, k-коэф. массоотдачи, F-площадь поверхности растворения. Пример. Растворение сахара в воде: попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды донорно-акцепторные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя.

2. Растворение жидкостей Пределы растворения в этом случае колеблются от 0 до бесконечности. Критическая температура растворения - температура, при которой ограниченная взаимная растворимость переходит в неограниченную. (фенол+вода t=66,4 C) Закон распределения: вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянной и не зависит от общего количества растворенного вещества. К – коэффициент распределения Экстракция – способ извлечения растворенного вещества из раствора с помощью второго растворителя, не смешивающегося с первым. (Йод в воде и йод хлороформе, к=130)

3. Растворение газов Растворение газов в воде – процесс экзотермический. Следовательно, при повышении температуры растворимость газов понижается. Растворение газов всегда приводит к понижению объема системы. Следовательно, с повышением давления растворимость повышается. Закон Генри — при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений: С=k p, C- массовая доля газа в насыщенном растворе, k – коэффициент Генри, p – парциальное давление

Способы выражения концентрации растворов Концентрация – количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя Обозначения: растворенное вещество - X, растворитель - S. 1. процентная концентрация (массовая доля) - число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора:

где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г. 2. Молярная концентрация (молярность, М, [моль/л]) - число молей растворенного вещества, содержащегося в 1 литре раствора: С(Х) = v(Х) / V, где С(Х) - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л. 3. Моляльность (m) – число молей растворенного вещества, приходящихся на 1000 г растворителя 4.Титр (Т) - число граммов растворённого вещества, содержащееся в 1мл раствора.

5. Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе: где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) – количество вещества растворителя S, моль. Cумма мольных долей растворенного вещества и растворителя равна 1: N(X) + N(S) = 1. 6. Нормальность (CN [г.экв./л])- число грамм-эквивалентов растворённого вещества, содержащееся в 1 литре раствора.

Растворы электролитов Электролит - вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты - проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью. Электролитическая диссоциация распад вещества на ионы под действием полярных молекул растворителя или при расплавлении . Диссоциация на ионы происходит вследствие взаимодействия растворённого вещества с растворителем.

Степень диссоциации (α) - отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита. Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты Сильные электролиты - электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты. Степень диссоциации сильных электролитов вычисляют по электропроводности их растворов Константа диссоциации (Кд) определяется активностями катионов аК+, анионов аА– и недиссоциированных молекул аКА следующим образом: Кд=(аК+ аА– )/ аКА Активность – это такая концентрация иона, соответственно которой он действует при химической реакции

Процесс диссоциации 1. Диссоциация солей в растворе. При растворении в воде электролиты распадаются на и ионы. Катионы – положительные ионы Анионы – отрицательные ионы В процессе диссоциации количество частиц в растворе значительно возрастает. В результате этого растворы электролитов проявляют аномальные свойства: Температура кипения выше, чему растворов неэлектролитов Температура замерзания ниже, чем у растворов неэлектролитов Слабые электролиты - степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p-, d-, и f-элементов. Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом - слабого.

Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α. Например, электролитическая диссоциация бинарного электролита КА выражается уравнением типа КА ↔ К+ + А–. Сложные вещества диссоциируют ступенчато: 2. Диссоциация полярных молекул в растворе Полярные молекулы, например молекулы воды, вызывают расхождение полюсов притянутой молекулы - поляризуют её. Такая поляризация в комбинации с колебательным тепловым движением атомов, а также с непрерывным тепловым движением окружающих её молекул приводит к распаду полярной молекулы на ионы и они гидратируются. При этом ион водорода Н+ прочно связывается с молекулой воды и образует ион гидроксония Н3О+.

3. Термическая диссоциация. Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи.

Диссоциация воды Вода – слабый электролит. H2O + H2O ↔ H3O+ + OH− или H2O ↔ H+ + OH− Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где: [H+] - концентрация ионов гидроксония (протонов); [OH−] - концентрация гидроксид-ионов; [H2O] - концентрация воды (в молекулярной форме) в воде; Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 22 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как: (1)
![Обозначим произведение K·[H2O]=Kв=1,8·10−16х55,56= 10−14моль²/л² = [H+]·[OH−] (п Обозначим произведение K·[H2O]=Kв=1,8·10−16х55,56= 10−14моль²/л² = [H+]·[OH−] (п](https://fs3.ppt4web.ru/images/132073/189660/310/img101.jpg)
Обозначим произведение K·[H2O]=Kв=1,8·10−16х55,56= 10−14моль²/л² = [H+]·[OH−] (при 22 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры - наоборот Для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами - соответственно, водородным показателем (pH) и гидрокcильным показателем (pOH).

Так как Kв - константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH] = моль/л. (pH=7) [H+] > 10−7 моль/л - pH 7 – среда кислая; [H+] < 10−7 моль/л) – pH 7 – среда щелочная.

Окислительно-восстановительные реакции Окислительно-восстановительные реакции - это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Zn0+2H+1Cl-1 = Zn+1Cl2-1+H20 Окисление: При окислении вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель окислитель + e− ↔ сопряжённый восстановитель

Восстановление: Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение валентности (степени окисления) элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель восстановитель - e− ↔ сопряжённый окислитель

Окислительно-востановительная реакция между водородом и фтором: Разделяется на две полуреакции: Окисление: Восстановление: Электрохимия Электрохимия - раздел химии, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах и в ионных проводниках, процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.

Электрохимические системы Электрохимическая система - система: - состоящая из двух электродов и находящегося с ними в контакте проводника второго рода (электролита); - в которой могут протекать как минимум одна электрохимическая реакция окисления и одна электрохимическая реакция восстановления вещества. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ - разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение Э. п. обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. Электростатический потенциал — скалярная энергетическая характеристика электростатического поля, характеризующая потенциальную энергию поля, которой обладает единичный заряд, помещённый в данную точку поля.

Уравнение Нернста Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста: где E0 - стандартный потенциал редокс-системы; R - универсальная газовая постоянная, равная 8,312 Дж/(моль К); T - абсолютная температура, К; F - постоянная Фарадея, равная 96485 Кл/моль; n - число электронов, принимающих участие в электродной реакции; aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы; [ox], [red] - их молярные концентрации; ox, red - коэффициенты активности.

Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным(lnN = 2,303lgN), то при T=298K получим:

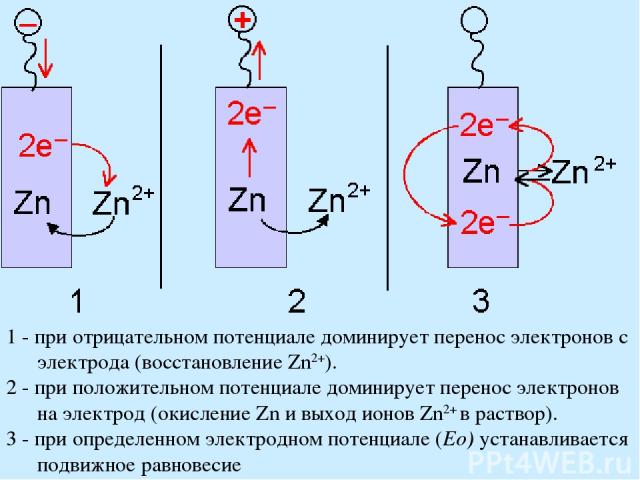
Атомы цинка могут переходить из металлической решетки в водный раствор в виде ионов цинка Zn2+; при этом освободившиеся электроны уходят по электрической цепи, т. е. происходит процесс: Преобладающее направление реакции зависит от разности потенциалов между электродом и окружающим раствором. Увеличение потенциала будет способствовать восстановлению ионов цинка до металлического цинка, тогда как его уменьшение - наоборот, окислению цинка до ионов Если пластинка металла, например цинка, погружена в воду, то будет наблюдаться подвижное равновесие. Возникновение электродного потенциала
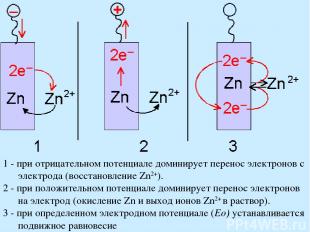
1 - при отрицательном потенциале доминирует перенос электронов с электрода (восстановление Zn2+). 2 - при положительном потенциале доминирует перенос электронов на электрод (окисление Zn и выход ионов Zn2+ в раствор). 3 - при определенном электродном потенциале (Eo) устанавливается подвижное равновесие
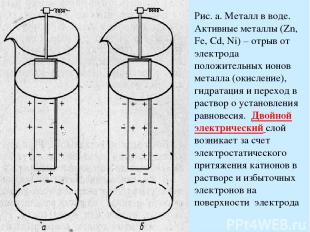
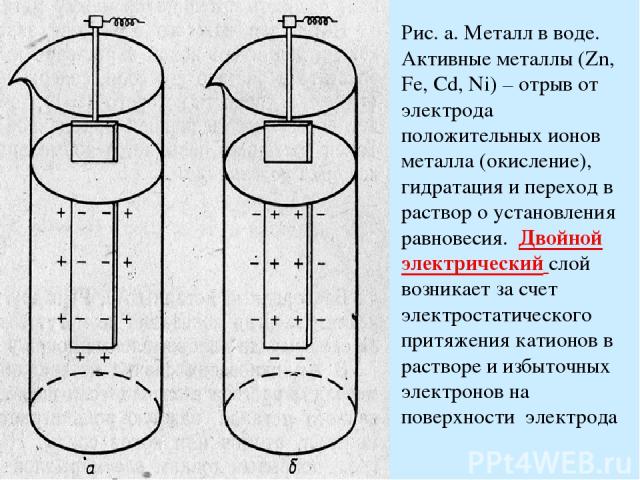
Рис. а. Металл в воде. Активные металлы (Zn, Fe, Cd, Ni) – отрыв от электрода положительных ионов металла (окисление), гидратация и переход в раствор о установления равновесия. Двойной электрический слой возникает за счет электростатического притяжения катионов в растворе и избыточных электронов на поверхности электрода

Рис. б. в случае неактивного металла равновесная концентрация ионов металла в растворе очень мала. При погружении в собственную соль, часть ионов металла восстановится на электроде. Электрод зарядится положительно, а раствор соли - отрицательно. Т.о, потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры. Стандартный электродный потенциал – потенциал, возникающий при погружении металла в раствор его соли концентрацией 1 г-ион на 1 литр (активность а=1). Возможно определить лишь относительное значение электродного потенциала к стандартному электроду. В качестве стандартного электрода используют обратимый водородный электрод (2Н+ Н2, Pt). Если водородный электрод соединен с электродом , окисляющимся легче водорода, то на нем восстанавливаются ионы водорода и наоборот.
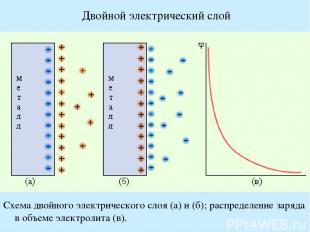
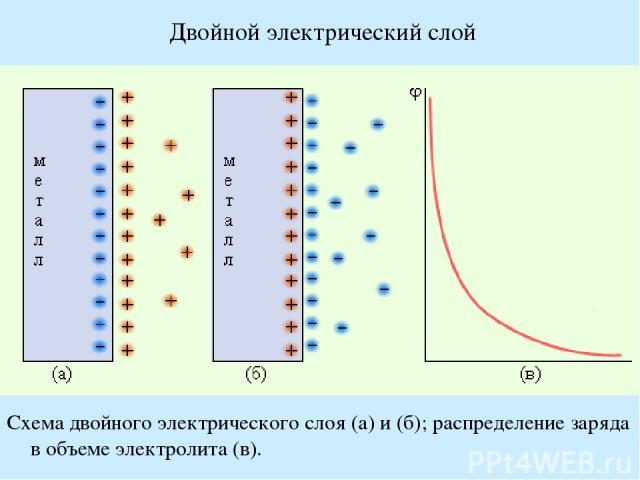
Двойной электрический слой Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в).
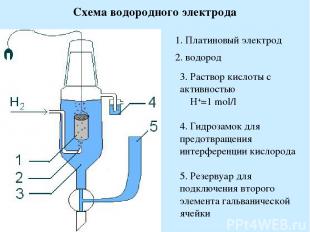
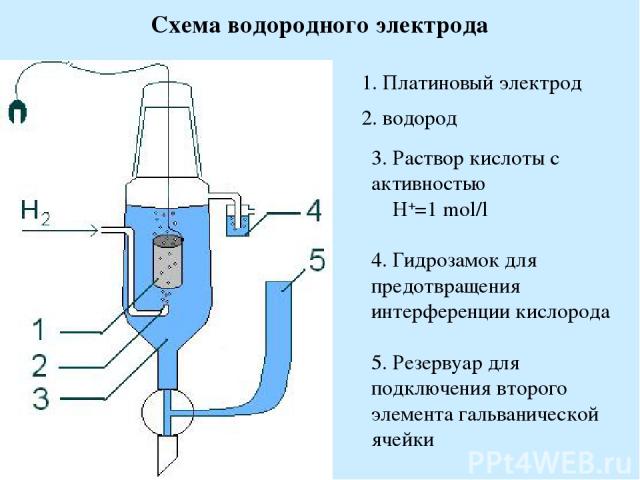
Схема водородного электрода 1. Платиновый электрод 2. водород 3. Раствор кислоты с активностью H+=1 mol/l 4. Гидрозамок для предотвращения интерференции кислорода 5. Резервуар для подключения второго элемента гальванической ячейки
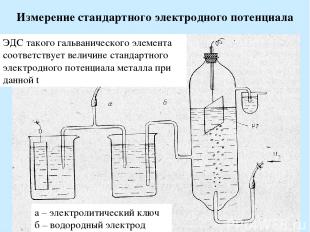
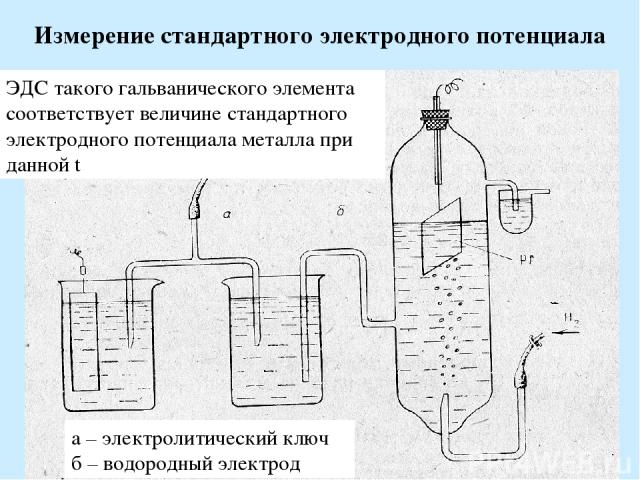
Измерение стандартного электродного потенциала а – электролитический ключ б – водородный электрод ЭДС такого гальванического элемента соответствует величине стандартного электродного потенциала металла при данной t

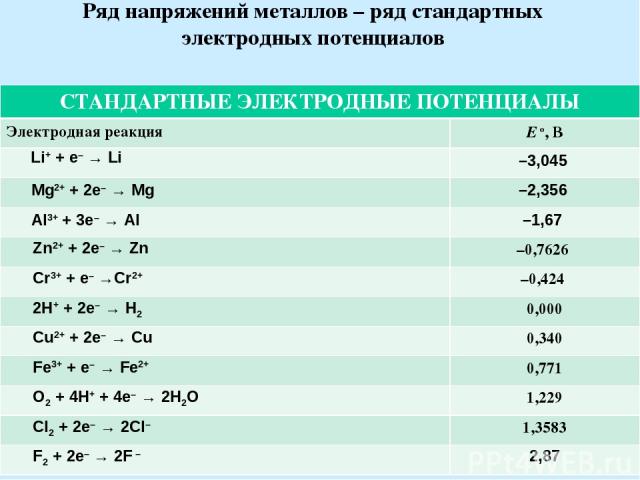
Ряд напряжений металлов – ряд стандартных электродных потенциалов СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ Электродная реакция E o, В Li+ + e– → Li –3,045 Mg2+ + 2e– → Mg –2,356 Al3+ + 3e– → Al –1,67 Zn2+ + 2e– → Zn –0,7626 Cr3+ + e– →Cr2+ –0,424 2H+ + 2e– → H2 0,000 Cu2+ + 2e– → Cu 0,340 Fe3+ + e– → Fe2+ 0,771 O2 + 4H+ + 4e– → 2H2O 1,229 Cl2 + 2e– → 2Cl– 1,3583 F2 + 2e– → 2F – 2,87

В ряду напряжений потенциалы расположены по возрастанию их величин, что соответствует уменьшению восстановительной и повышению окислительной активности соответствующих систем. Если составить электрохимическую цепь из двух электроходов этого ряда, то на одном из них, потенциал которого ниже по сравнению с другим, будет идти процесс окисления, а на другом – процесс восстановления. Ряд напряжений характеризует химические свойства металлов: Чем левее в ряду напряжений находится металл, тем он химически активнее, тем легче окисляется и трудней восстанавливается из своих ионов Каждый металл этого ряда, не разлагающий воду, вытесняет все следующие за ним металлы из растворов их солей. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот, а стоящие правее водорода его не вытесняют.

4. Чем дальше расположены друг от друга в ряду напряжений два данных металла, тем большую ЭДС будет иметь построенный из них биметаллический гальванический элемент. Величина электродного потенциала металла зависит от свойств металла, активности его ионов в растворе, и температуры.

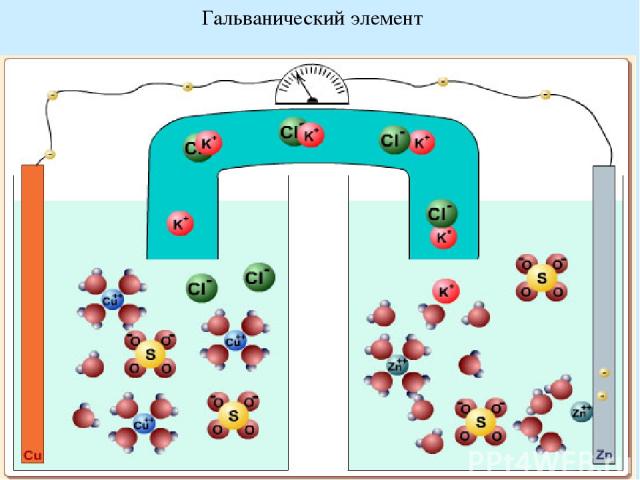
Гальванические элементы Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Если в гальваническом элементе протекают обратимые химические реакции, то он называется аккумулятором. Zn+Cu2+=Cu+Zn2+ Zn= Zn2++2e- Cu2++2 e- = Cu Если пространственно разделить окислитель и восстановитель, то электроны будут переходить от восстановителя к окислителю по проводу, т.е. возникнет электрический ток
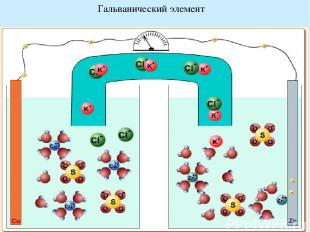
Гальванический элемент

Катод - отрицательный полюс источника тока ( гальванического элемента, электрической батареи и т. д.) или электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока. При процессах электролиза (получение элементов из их растворов и расплавов под действием постоянного электрического тока), катод - отрицательный полюс, на нём происходит восстановление металла. Анод - положительный полюс источника тока ( гальванического элемента, электрической батареи и т. д.). Потенциал анода при работе источника положителен по отношению к потенциалу катода. При процессах электролиза (получение элементов из их растворов и расплавов под действием постоянного электрического тока), анод - положительный полюс, на нём происходит окисление. ЭДС всякого гальванического элемента – величина положительная. Вычисляется по разности электродных потенциалов и характеризует максимально полезную работу, которая может быть произведена системой при протекании данной реакции.

ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя). (–)Zn¦Zn2+||Cu2+¦Cu(+) Для нестандартных условий ЭДС элемента находится из разности электродных потенциалов, вычисленных по уравнению Нернста
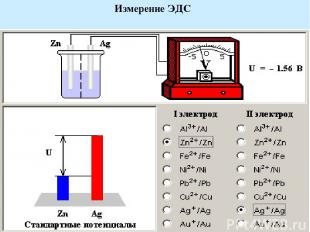
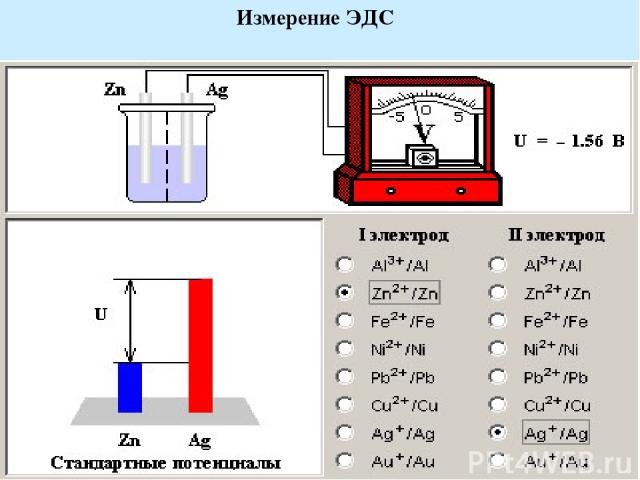
Измерение ЭДС

Электролиз Электролиз - физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита. На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).

Законы Фарадея Первый закон Фарадея: масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит: k - электрохимический эквивалент вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества Второй закон Фарадея: Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты. Химическим эквивалентом иона называется отношение молярной массы (A) иона к его валентности z. Поэтому электрохимический эквивалент: F - постоянная Фарадея = 96 485,3383(83) Кл·моль-1














































![З-н действия масс (1867г Гульдберг и Вааге) – при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ: 2A+B=C V=k[A]2[B] Гетерогенные реакции: C+O2=CO2 V=k[O2] k – не зависит от концентра… З-н действия масс (1867г Гульдберг и Вааге) – при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ: 2A+B=C V=k[A]2[B] Гетерогенные реакции: C+O2=CO2 V=k[O2] k – не зависит от концентра…](https://fs3.ppt4web.ru/images/132073/189660/640/img71.jpg)
![Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение привело к химической реакции. [кДж/моль]. Энергия активации зависит от природы реагирующих веществ. Активированный комплекс – неустойчивое проме… Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение привело к химической реакции. [кДж/моль]. Энергия активации зависит от природы реагирующих веществ. Активированный комплекс – неустойчивое проме…](https://fs3.ppt4web.ru/images/132073/189660/640/img72.jpg)



![Химическое равновесие – состояние системы, при котором скорость прямой реакции равняется скорости обратной Константа химического равновесия V1 H2+J2 2HJ V2 V1=k1[H2][I2] V2=k2[HI]2 При гетерогенной реакции в расчет К входят только те вещества, котор… Химическое равновесие – состояние системы, при котором скорость прямой реакции равняется скорости обратной Константа химического равновесия V1 H2+J2 2HJ V2 V1=k1[H2][I2] V2=k2[HI]2 При гетерогенной реакции в расчет К входят только те вещества, котор…](https://fs3.ppt4web.ru/images/132073/189660/640/img81.jpg)











![где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г. 2. Молярная концентрация (молярность, М, [моль/л]) - число молей растворенного вещества,… где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г. 2. Молярная концентрация (молярность, М, [моль/л]) - число молей растворенного вещества,…](https://fs3.ppt4web.ru/images/132073/189660/640/img93.jpg)






![Диссоциация воды Вода – слабый электролит. H2O + H2O ↔ H3O+ + OH− или H2O ↔ H+ + OH− Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где: [H+] - концентрация ионов гидроксония (протонов); [OH−] - … Диссоциация воды Вода – слабый электролит. H2O + H2O ↔ H3O+ + OH− или H2O ↔ H+ + OH− Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где: [H+] - концентрация ионов гидроксония (протонов); [OH−] - …](https://fs3.ppt4web.ru/images/132073/189660/640/img100.jpg)
![Обозначим произведение K·[H2O]=Kв=1,8·10−16х55,56= 10−14моль²/л² = [H+]·[OH−] (при 22 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой … Обозначим произведение K·[H2O]=Kв=1,8·10−16х55,56= 10−14моль²/л² = [H+]·[OH−] (при 22 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой …](https://fs3.ppt4web.ru/images/132073/189660/640/img101.jpg)
![Так как Kв - константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH] = моль/л. (pH=7) [H+] > 10−7 моль/л - pH 7 – среда кислая; [H+] < 10−7 моль/л) – pH 7 – с… Так как Kв - константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH] = моль/л. (pH=7) [H+] > 10−7 моль/л - pH 7 – среда кислая; [H+] < 10−7 моль/л) – pH 7 – с…](https://fs3.ppt4web.ru/images/132073/189660/640/img102.jpg)