Презентация на тему: Атом в физике

Зимин Арсений, Руссов Алексей. Санкт-Петербург 2011 Руководитель: Саркисян А.В. 900igr.net

Содержание. Представление атома Джозефа Томпсона. Опыты Резерфорда. “Кино” про то, как выглядит атом. Постулаты Бора. Волновые свойства электрона. Литература.

Джозеф Джон Томсон Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.)
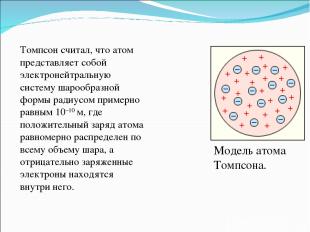
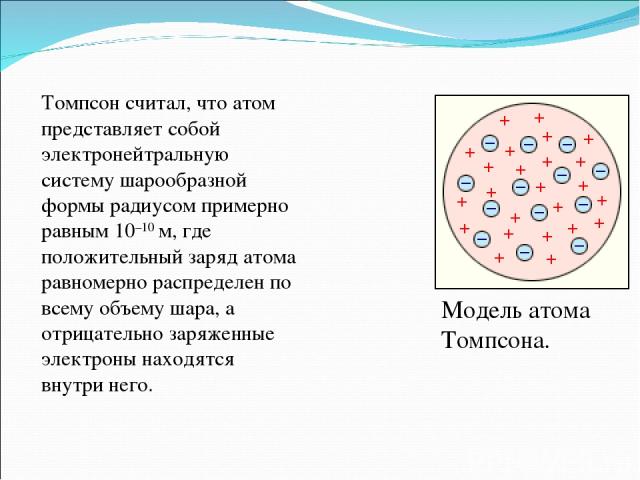
Модель атома Томпсона. Томпсон считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м, где положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него.

Эрнест Резерфорд Родился 30 августа 1871, в Спринг Грув (Пенсильвания, США), умер 19 октября 1937, в Кембридже (Англия). Резерфорд известен как «отец» ядерной физики, создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 года.

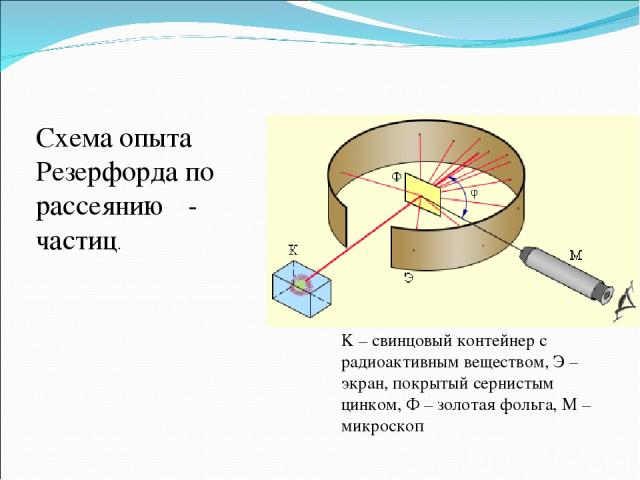
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду.

K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп Схема опыта Резерфорда по рассеянию α-частиц.

Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n2 раз.

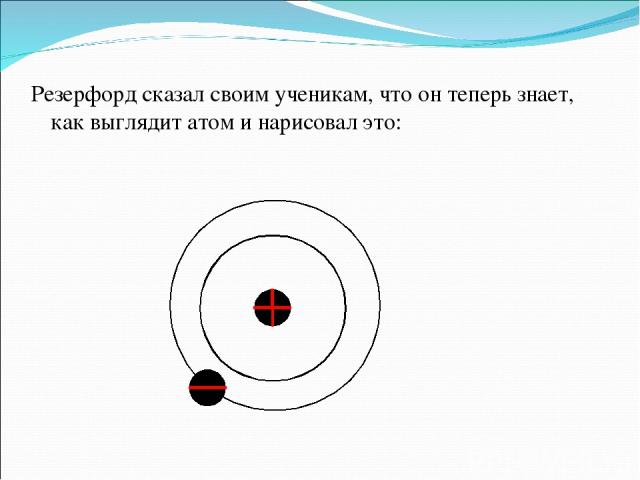
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны.
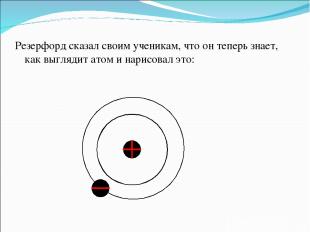
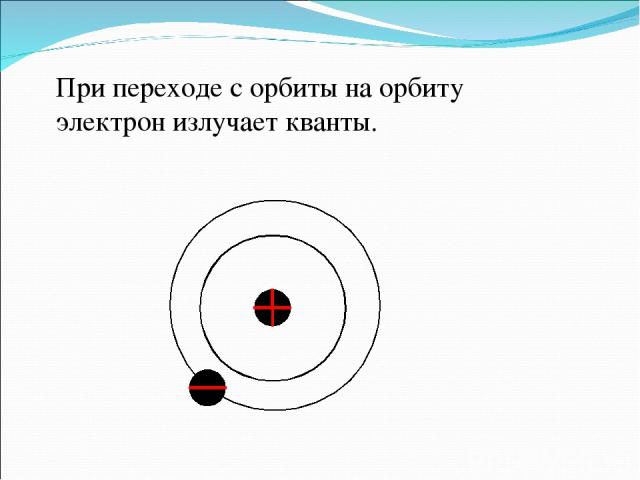
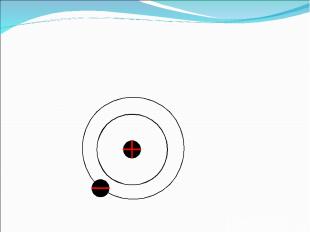
Резерфорд сказал своим ученикам, что он теперь знает, как выглядит атом и нарисовал это:
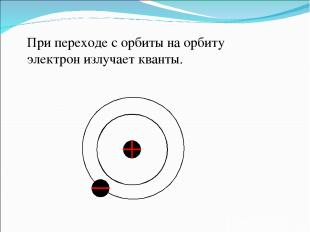
При переходе с орбиты на орбиту электрон излучает кванты.

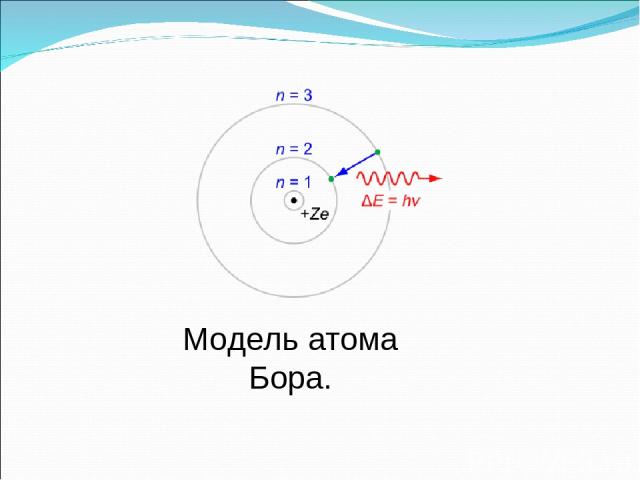
Постулаты Бора Атом может находиться не во всех состояниях, допускаемых классической физикой, а только в особых стационарных состояниях, каждому из которых соответствует своя определенная энергия Еn. В стационарном состоянии атом не излучает.

При переходе атома из одного стационарного состояния в другое излучается или поглощается фотон с энергией hv, равной разности энергии стационарных состояний. hv= IEn- EmI Второй постулат

В стационарном состоянии электрон может двигаться только по такой ("разрешенной") орбите, радиус которой удовлетворяет условию: Третий постулат mvr=nh h= h 2П
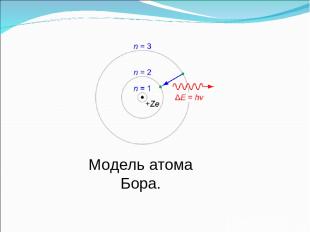
Модель атома Бора.

Альберт Эйнштейн “Я как страус окуну голову в песок относительности, лишь бы не глядеть в лицо этим гадким квантам.”
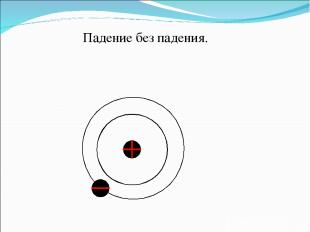
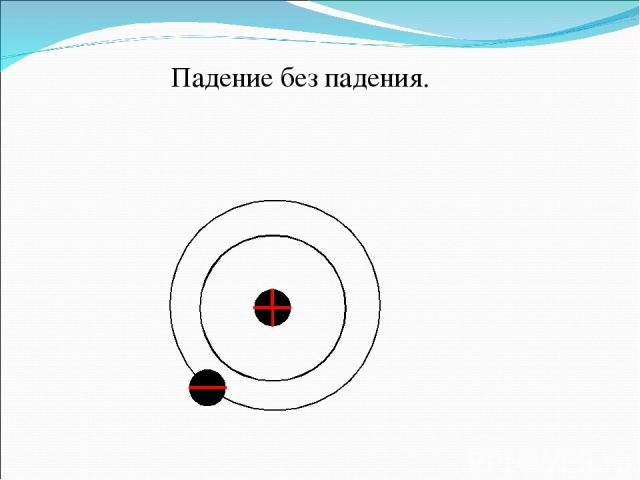
Падение без падения.

Луи Де Бройль В 1924 году французский физик Луи де Бройль высказал гипотезу о том, что установленный ранее для фотонов корпускулярно-волновой дуализм присущ всем частицам — электронам, протонам, атомам и так далее, причём количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и для фотонов.

Волны Де Бройля Если если частица имеет энергию E и импульс, абсолютное значение которого равно p, то с ней связана волна, частота которой ν = E / h и длина волны λ = h / p, где h — постоянная Планка. Эти волны и получили название волн де Бройля.

В квантовой физике ничего нельзя изобразить, просто потому что ничего нельзя увидеть. Заключение

Литература: П.Г. Крюков “Библиотечка КВАНТ. Выпуск 110” Б.М. Яворский, Ю.А. Слезнев «Курс физики» С.А. Баляева, А.Н. Углова «Физика для абитуриентов» Г.Я. Мякишев, Б.Б. Буховцев «Физика 11 класс» Интернет ресурсы