Презентация на тему: Строение атома

Строение атома 11 класс

Первая гипотеза строения атома предложена английским учёным Томсоном(1904)-статическая или электронно-ионная теория

Для проверки гипотезы Томсона Резерфорд (1911) провёл серию опытов по рассеиванию альфа -частиц тонкими металлическими пластинами. Для проверки гипотезы Томсона Резерфорд (1911) провёл серию опытов по рассеиванию альфа -частиц тонкими металлическими пластинами.

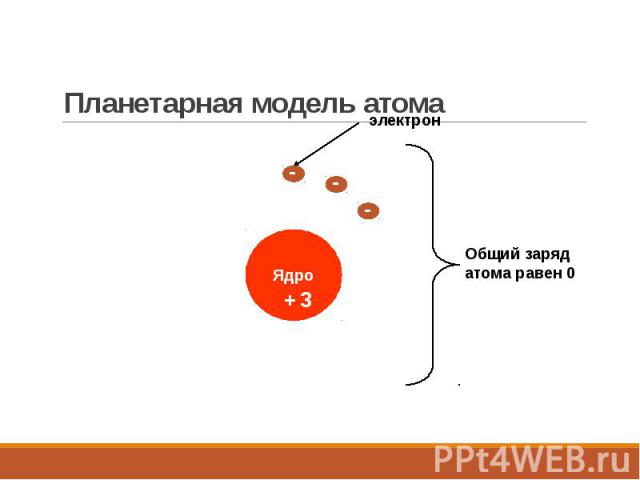
Планетарная модель атома

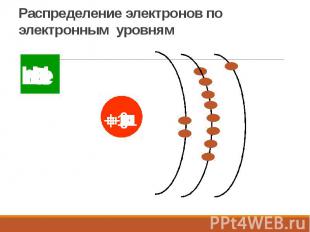
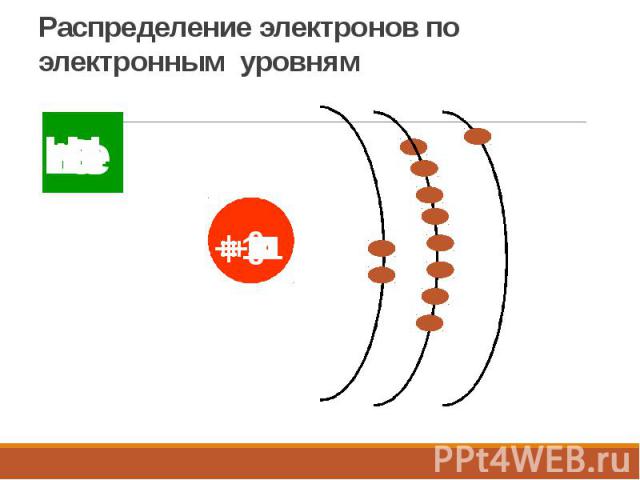
Распределение электронов по электронным уровням
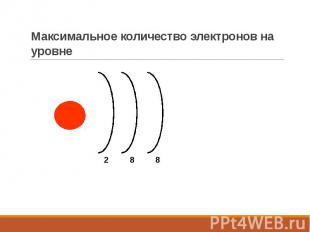
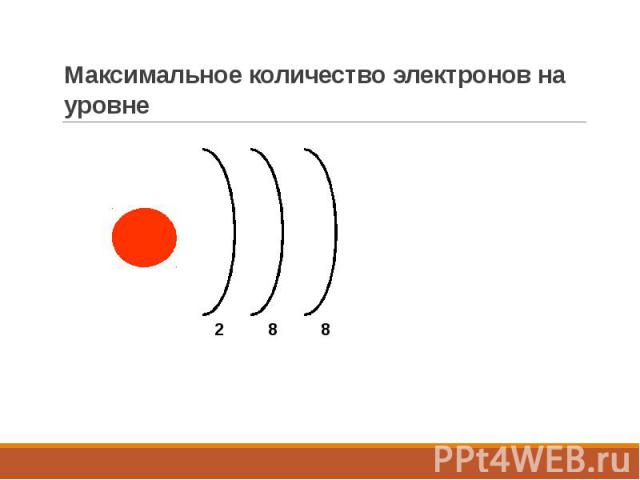
Максимальное количество электронов на уровне

Заполнение электронами четвертого энергетического уровня


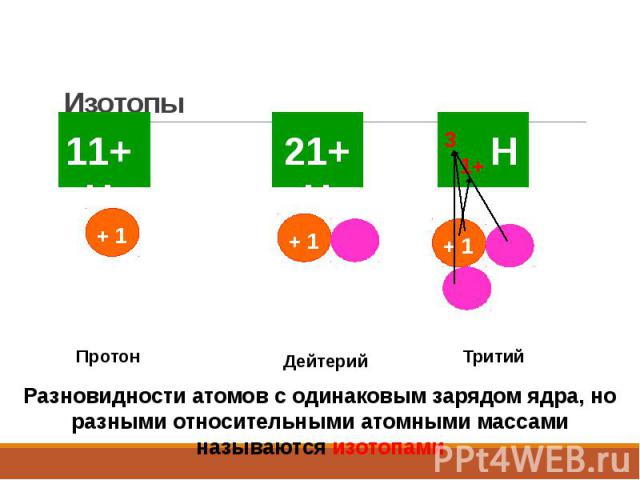
Изотопы Изотопы − атомы с одинаковыми значениями Z, но различными А то есть разное число нейтронов n0
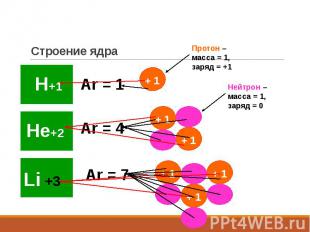
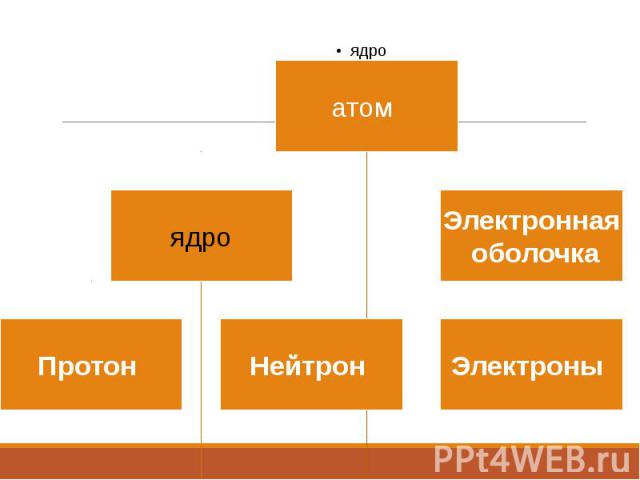
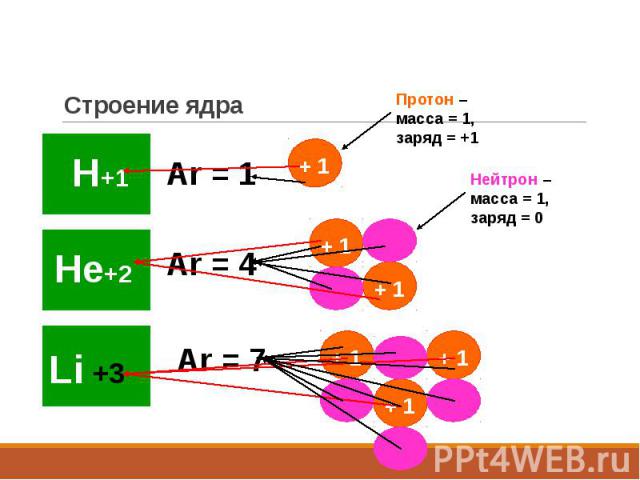
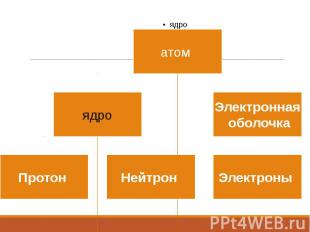
Строение ядра
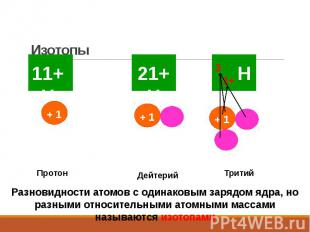
Изотопы

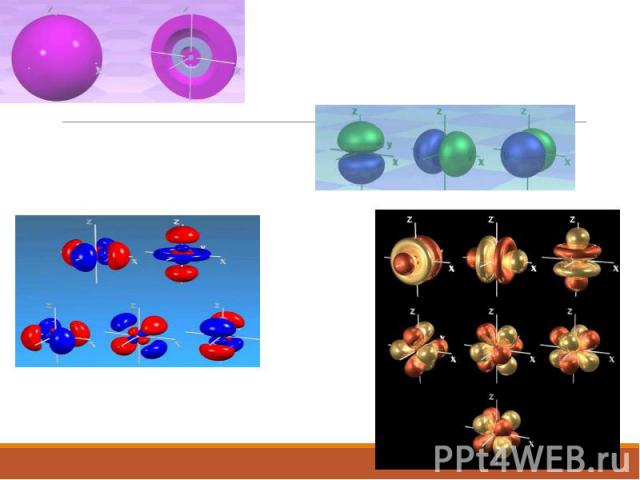
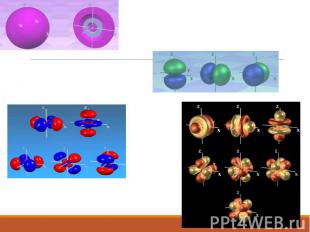
Электронное облако

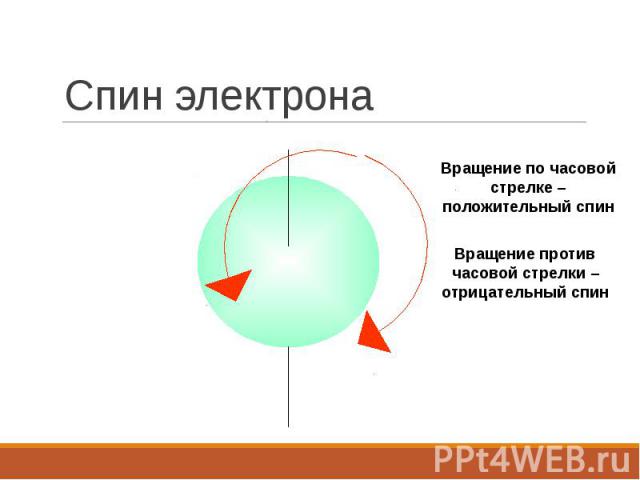
Спин электрона

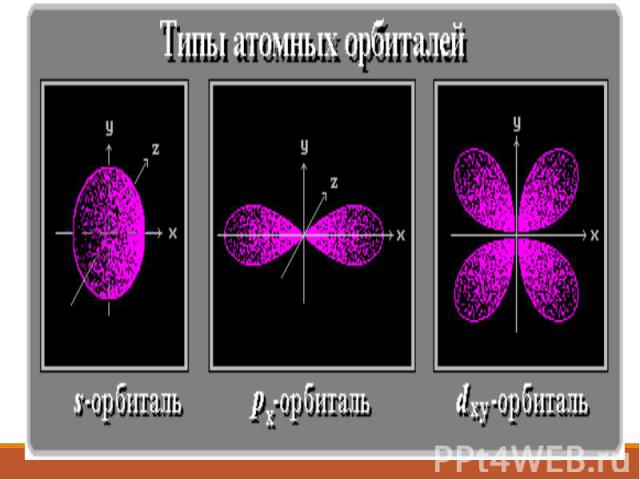
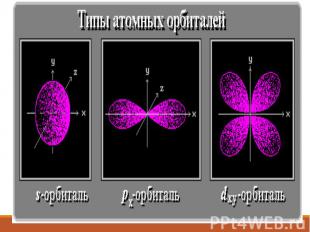
Формы электронных облаков
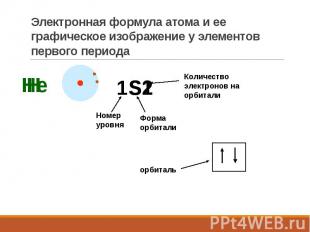
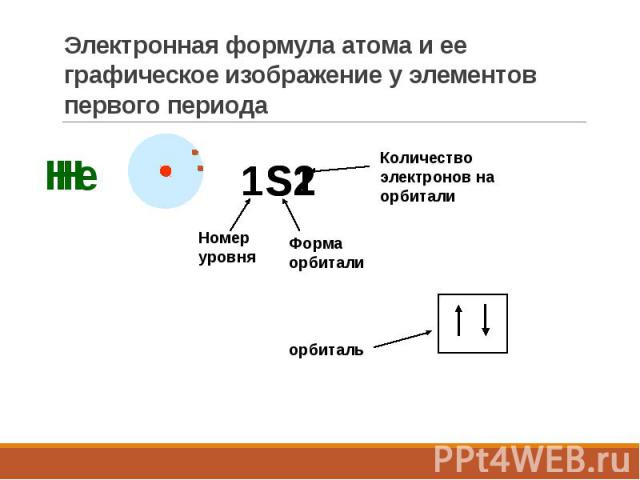
Электронная формула атома и ее графическое изображение у элементов первого периода
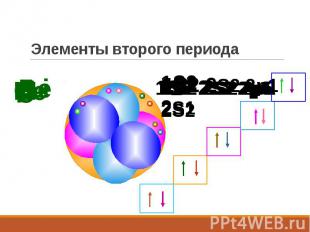
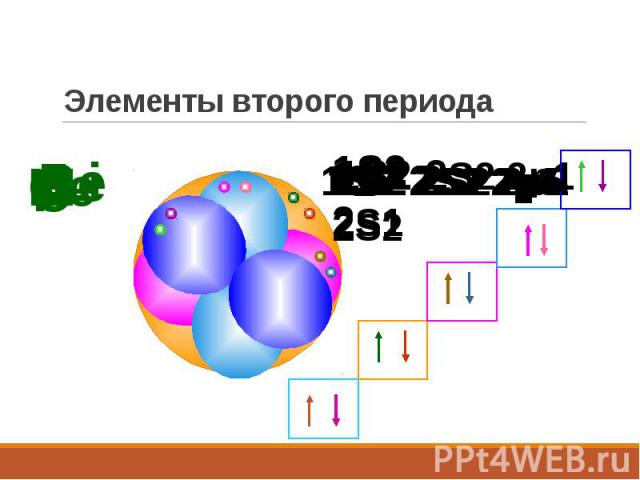
Элементы второго периода
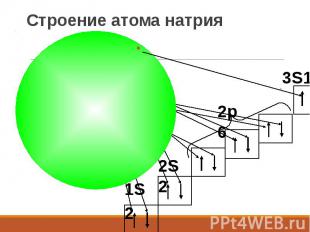
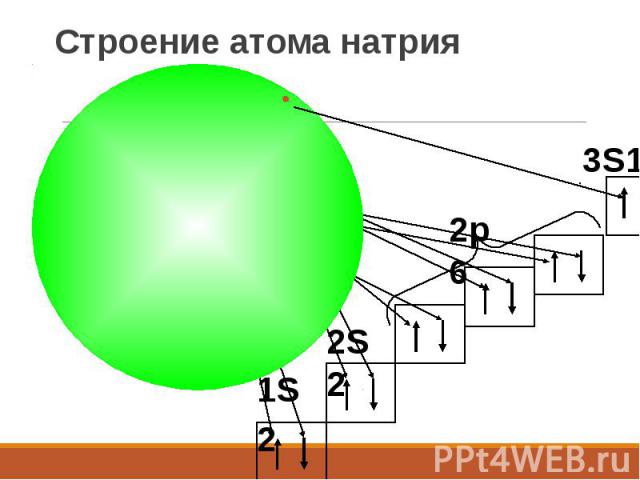
Строение атома натрия

Изменение внешнего электронного уровня у элементов третьего периода
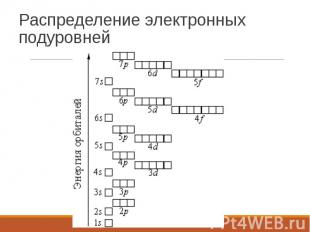
Распределение электронных подуровней

Электронная формула 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 5f……7f

Валентные электроны

Точный "адрес" электрона в оболочке определяется с помощью Точный "адрес" электрона в оболочке определяется с помощью квантовых чисел.

ℓ-орбитальное квантовое число, номер для подуровня ℓ-орбитальное квантовое число, номер для подуровня

Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с ℓ и может принимать целочисленные значения ℓ от –l до +l через 0.

Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может принимать значения +½ и –½

Принцип Паули или запрета : Принцип Паули или запрета : Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел.