Презентация на тему: Строение атома

Строение атома
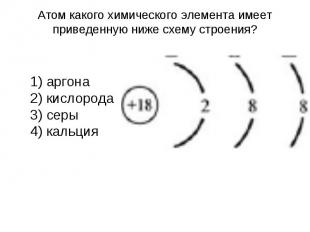
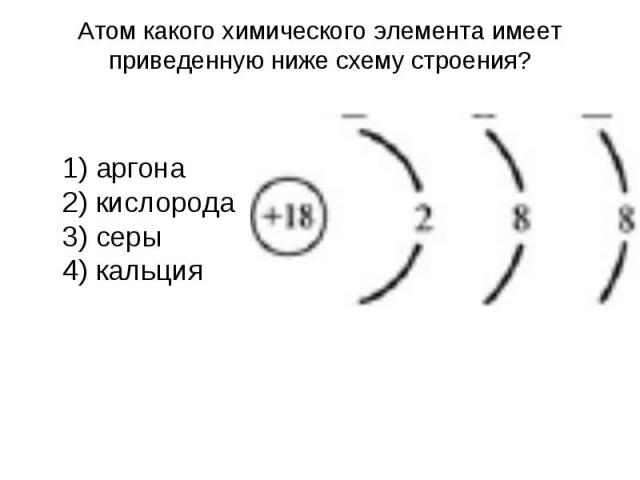
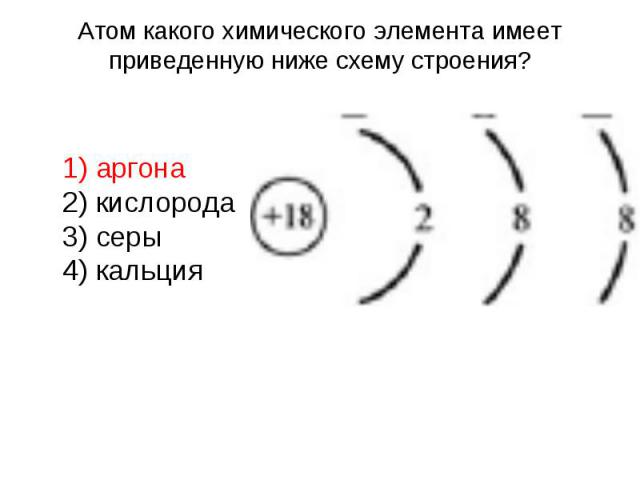
Атом какого химического элемента имеет приведенную ниже схему строения? 1) аргона 2) кислорода 3) серы 4) кальция
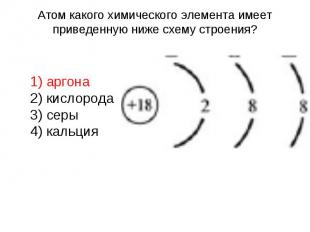
Атом какого химического элемента имеет приведенную ниже схему строения? 1) аргона 2) кислорода 3) серы 4) кальция



Элементу не хватает 3 электронов до завершения энергетического уровня. Порядковый номер элемента в периодической системе: Элементу не хватает 3 электронов до завершения энергетического уровня. Порядковый номер элемента в периодической системе: 1) 3 2) 5 3) 7 4) 11

Элементу не хватает 3 электронов до завершения энергетического уровня. Порядковый номер элемента в периодической системе: Элементу не хватает 3 электронов до завершения энергетического уровня. Порядковый номер элемента в периодической системе: 1) 3 2) 5 3) 7 4) 11

В атоме элемента число электронов на внешнем уровне в два раза превышает В атоме элемента число электронов на внешнем уровне в два раза превышает число внутренних электронов. Какой это элемент? 1) литий 3) кислород 2) углерод 4) сера

В атоме элемента число электронов на внешнем уровне в два раза превышает В атоме элемента число электронов на внешнем уровне в два раза превышает число внутренних электронов. Какой это элемент? 1) литий 3) кислород 2) углерод 4) сера

Атом элемента содержит на внешнем энергетическом уровне 3 электрона. Порядковый номер элемента в периодической системе: Атом элемента содержит на внешнем энергетическом уровне 3 электрона. Порядковый номер элемента в периодической системе: 1) 3 2) 5 3) 7 4) 11

Атом элемента содержит на внешнем энергетическом уровне 3 электрона. Порядковый номер элемента в периодической системе: Атом элемента содержит на внешнем энергетическом уровне 3 электрона. Порядковый номер элемента в периодической системе: 1) 3 2) 5 3) 7 4) 11

В атоме элемента два энергетических уровня заполнены электронами, а на В атоме элемента два энергетических уровня заполнены электронами, а на третьем находится 4 электрона. Какой это элемент? 1) кремний 2) углерод 3) кислород 4) сера

В атоме элемента два энергетических уровня заполнены электронами, а на В атоме элемента два энергетических уровня заполнены электронами, а на третьем находится 4 электрона. Какой это элемент? 1) кремний 2) углерод 3) кислород 4) сера

На приведённом рисунке На приведённом рисунке изображена модель атома 1) хлора 2) азота 3) магния 4) фтора

На приведённом рисунке На приведённом рисунке изображена модель атома 1) хлора 2) азота 3) магния 4) фтора
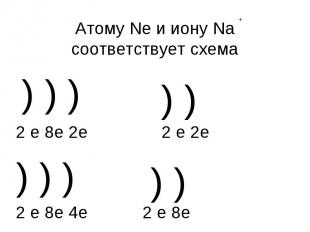
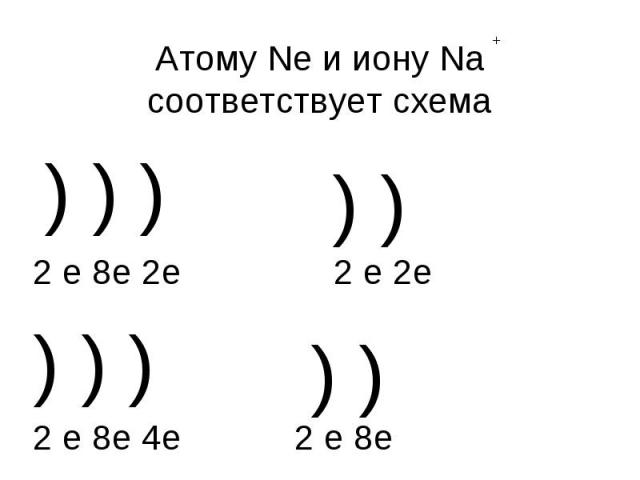
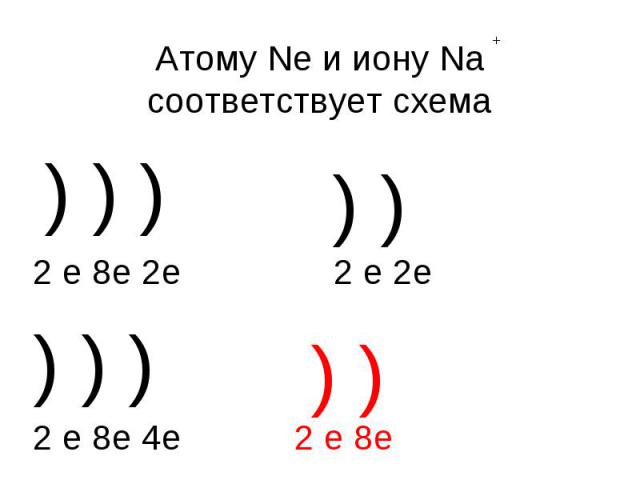
Атому Ne и иону Na соответствует схема
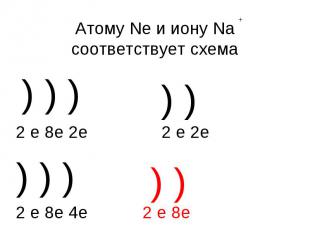
Атому Ne и иону Na соответствует схема
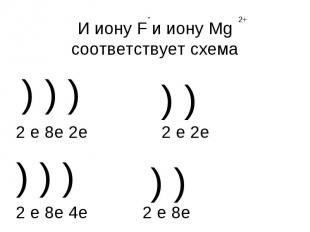
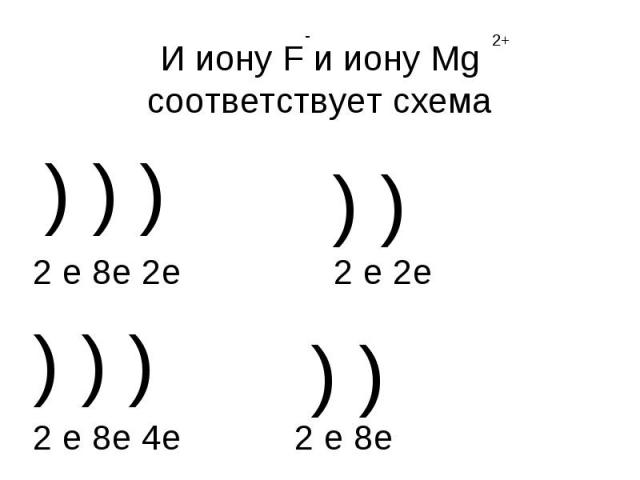
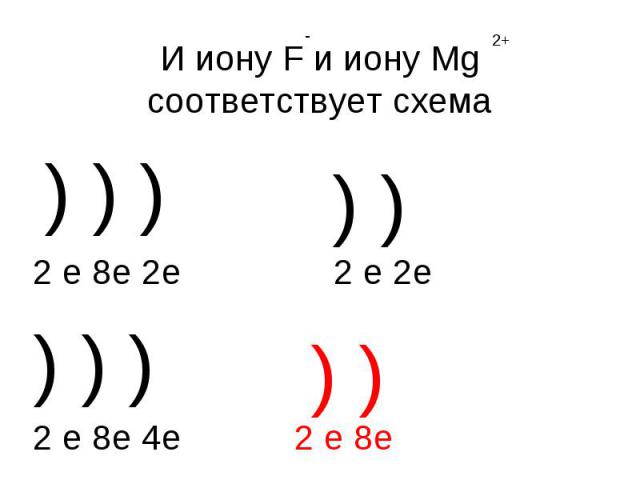
И иону F и иону Mg соответствует схема
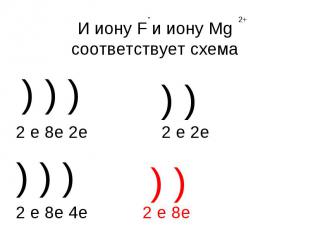
И иону F и иону Mg соответствует схема
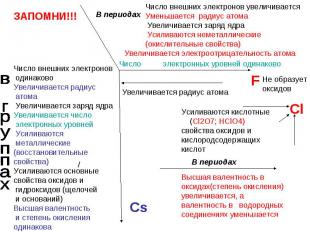
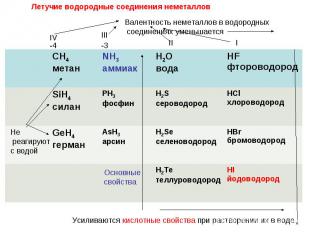

От кислотных к оснóвным меняются свойства оксидов в ряду 1) CaO → SiO2 → SO3 2) CO2 → Al2O3 → MgO 3) SO3 → P2O5 → Al2O3 4) Na2O → MgO → Al2O3

От кислотных к оснóвным меняются свойства оксидов в ряду 1) CaO → SiO2 → SO3 2) CO2 → Al2O3 → MgO 3) SO3 → P2O5 → Al2O3 4) Na2O → MgO → Al2O3

В ряду O – S – Se – Te увеличивается В ряду O – S – Se – Te увеличивается 1) электроотрицательность элемента 2) валентность элемента в водородном соединении 3) высшая степень окисления 4) радиус атома

В ряду O – S – Se – Te увеличивается В ряду O – S – Se – Te увеличивается 1) электроотрицательность элемента 2) валентность элемента в водородном соединении 3) высшая степень окисления 4) радиус атома

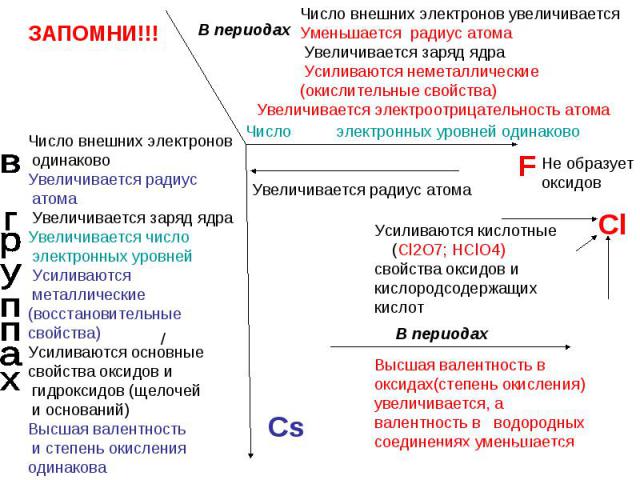
В каком ряду химических элементов увеличивается радиус атома? 1) литий – бериллий – бор 2) кальций – магний – бериллий 3) фосфор – сера – хлор 4) гелий – неон – аргон

В каком ряду химических элементов увеличивается радиус атома? 1) литий – бериллий – бор 2) кальций – магний – бериллий 3) фосфор – сера – хлор 4) гелий – неон – аргон

В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ? 1) алюминий → фосфор → хлор 2) фтор → азот → углерод 3) хлор → бром → иод 4) кремний → сера → фосфор

В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ? 1) алюминий → фосфор → хлор 2) фтор → азот → углерод 3) хлор → бром → иод 4) кремний → сера → фосфор

Валентность элемента в водородном соединении уменьшается в ряду Валентность элемента в водородном соединении уменьшается в ряду 1) S → Se → Te 3) Cl → Br → I 2) S → P → Si 4) N → O → F

Валентность элемента в водородном соединении уменьшается в ряду Валентность элемента в водородном соединении уменьшается в ряду 1) S → Se → Te 3) Cl → Br → I 2) S → P → Si 4) N → O → F

Валентность элемента в высшем оксиде растёт в ряду Валентность элемента в высшем оксиде растёт в ряду 1) Be B C 3) Cl Br I 2) Ca Sr Mg 4) H Li Na

Валентность элемента в высшем оксиде растёт в ряду Валентность элемента в высшем оксиде растёт в ряду 1) Be B C 3) Cl Br I 2) Ca Sr Mg 4) H Li Na

В ряду F – Cl – Br – I уменьшается 1) электроотрицательность элемента 2) радиус атома 3) число электронов в атоме 4) число заполненных электронных слоев в атоме

В ряду F – Cl – Br – I уменьшается 1) электроотрицательность элемента 2) радиус атома 3) число электронов в атоме 4) число заполненных электронных слоев в атоме

Элемент 3-его периода главной подгруппы II группы образует высший гидроксид, общая формула которого 1) Э(ОН)2 2) Н2ЭО3 3) Э(ОН)3 4) НЭО3

Элемент 3-его периода главной подгруппы II группы образует высший гидроксид, общая формула которого 1) Э(ОН)2 2) Н2ЭО3 3) Э(ОН)3 4) НЭО3

Запомни СО, N2O,NO – несолеобразующие оксиды!!! Всем другим оксидам соответствуют гидроксиды: Оксидам металлов (основным) – основания CaO Ca(OH)2 - гидроксид кальция Амфотерным оксидам (Al2O3, BeO,ZnO и Cr2O3) –амфотерные гидроксиды –например Al(OH)3 Оксидам неметаллов (кислотным) – кислоты P2O5 H3PO4 –фосфорная кислота И основания и кислородные кислоты являются гидроксидами, но формулы кислот записываются так, что атомы Н впереди и каждая кислота имеет своё конкретное название…

Элемент 2- oго периода главной подгруппы V группы образует высший гидроксид, формула которого 1 Э(ОН)2 2 Н2Э Э(ОН)3 НЭO3

Элемент 2- oго периода главной подгруппы V группы образует высший гидроксид, формула которого 1 Э(ОН)2 2 Н2Э Э(ОН)3 НЭO3

Часть В – выбрать 2 ответа

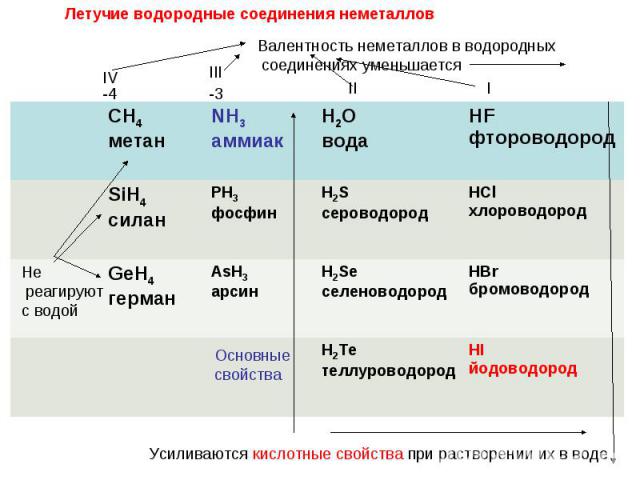
В каких рядах элементы расположены в порядке усиления кислотных свойств их летучих водородных соединений? 1) F – Cl – Br 2) As – P – N 3) N – O – F 4) Se – S – O 5) Cl – S – P

В каких рядах элементы расположены в порядке усиления кислотных свойств их летучих водородных соединений? 1) F – Cl – Br 2) As – P – N 3) N – O – F 4) Se – S – O 5) Cl – S – P

В каких рядах элементы расположены в порядке уменьшения кислотных свойств их летучих водородных соединений? 1) N – O – F 2) Se – S – O 3) F – Cl – Br 4) O – N – C 5) Si – P – S

В каких рядах элементы расположены в порядке уменьшения кислотных свойств их летучих водородных соединений? 1) N – O – F 2) Se – S – O 3) F – Cl – Br 4) O – N – C 5) Si – P – S

В каком ряду химические элементы расположены в порядке увеличения их электроотрицательности 1) Be – Mg – Ca 2) C – Si – Ge 3) As – P – N 4) Si – Al – Mg 5) Si – P – S

В каком ряду химические элементы расположены в порядке увеличения их электроотрицательности 1) Be – Mg – Ca 2) C – Si – Ge 3) As – P – N 4) Si – Al – Mg 5) Si – P – S





В ряду химических элементов: Al → Si → P – происходит увеличение (усиление) 1) числа протонов в ядрах атомов 2) числа заполняемых электронных слоёв в атомах 3)радиуса атомов 4)металлических свойств 5) степени окисления в высших оксидах

В ряду химических элементов: Al → Si → P – происходит увеличение (усиление) 1) числа протонов в ядрах атомов 2) числа заполняемых электронных слоёв в атомах 3)радиуса атомов 4)металлических свойств 5) степени окисления в высших оксидах

В ряду химических элементов Si — Ge — Sn 1) увеличивается число электронных слоев в атомах 2) уменьшается число протонов в ядрах атомов 3) увеличивается значение электроотрицательности 4) усиливается оснóвный характер высших оксидов 5) увеличивается число электронов во внешнем слое атомов

В ряду химических элементов Si — Ge — Sn 1) увеличивается число электронных слоев в атомах 2) уменьшается число протонов в ядрах атомов 3) увеличивается значение электроотрицательности 4) усиливается оснóвный характер высших оксидов 5) увеличивается число электронов во внешнем слое атомов

В ряду химических элементов C – Si – Ge увеличивается 1) радиус атома 2) высшая степень окисления 3) валентность элемента в летучем водородном соединении 4) число заполненных электронных слоев 5) число электронов на внешнем уровне

В ряду химических элементов C – Si – Ge увеличивается 1) радиус атома 2) высшая степень окисления 3) валентность элемента в летучем водородном соединении 4) число заполненных электронных слоев 5) число электронов на внешнем уровне

В ряду химических элементов Si – P – S увеличивается 1) радиус атома 2) высшая степень окисления 3) валентность элемента в летучем водородном соединении 4) число заполненных электронных слоев 5) кислотный характер высшего оксида

В ряду химических элементов Si – P – S увеличивается 1) радиус атома 2) высшая степень окисления 3) валентность элемента в летучем водородном соединении 4) число заполненных электронных слоев 5) кислотный характер высшего оксида