Презентация на тему: Валентные состояния атома углерода

Валентные состояния атома углерода
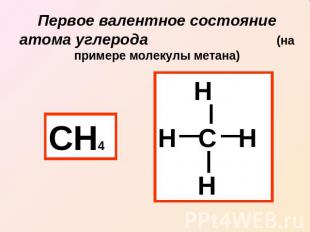
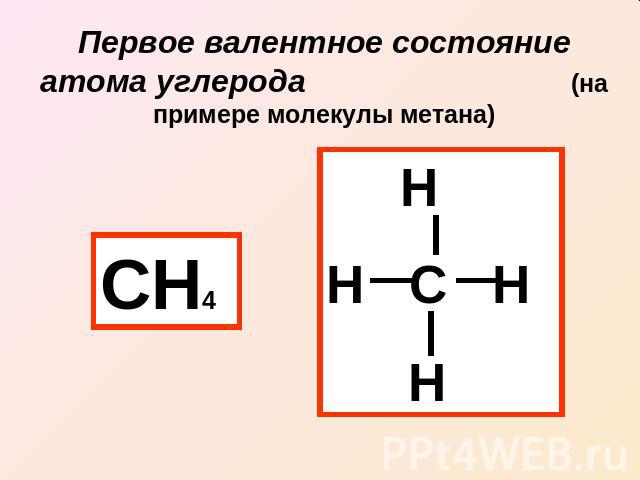
Первое валентное состояние атома углерода (на примере молекулы метана)

Два «противоречия» в строении метана: 1 противоречие: Валентность углерода равна четырем в наличии только 2 валентных электрона Решение: Выход в возбужденное состояние атома углерода

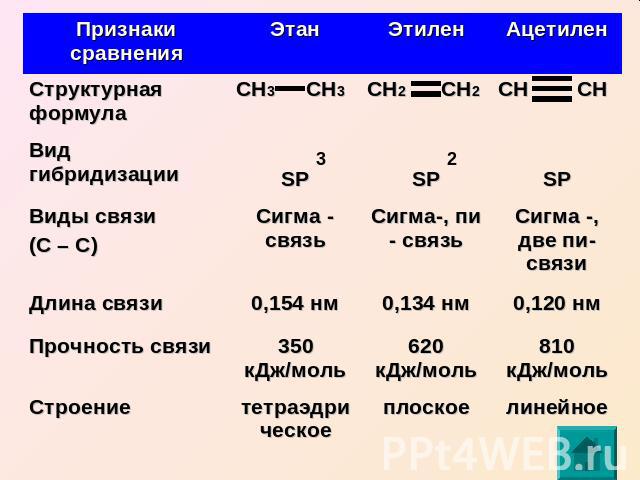
2 противоречие: В молекуле все четыре связи одинаковые по теории – одна SS связь и три SP связи Решение: SP гибридизация
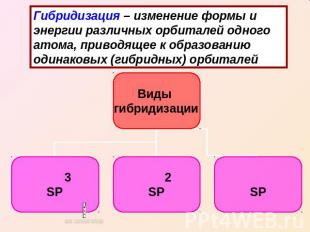
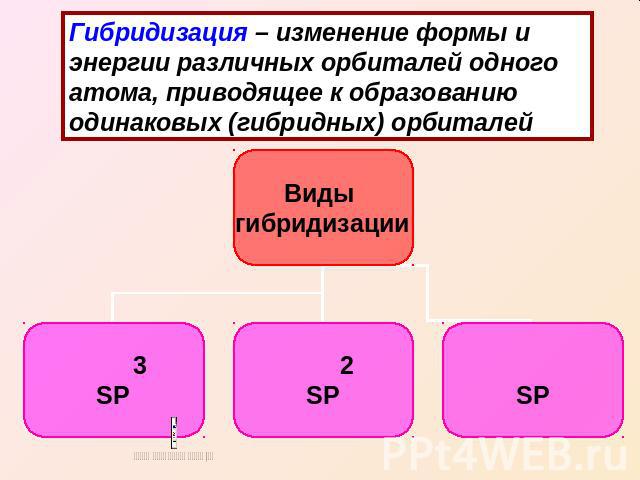
Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей
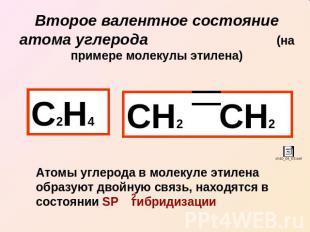
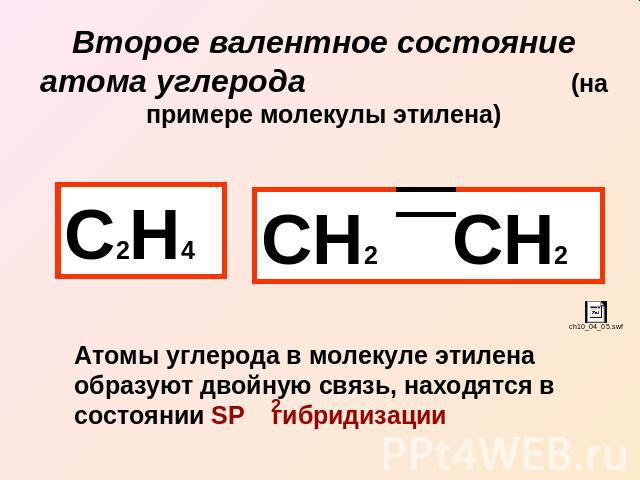
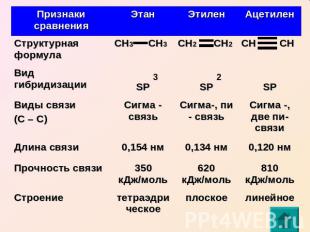
Второе валентное состояние атома углерода (на примере молекулы этилена) С2Н4 СН2 СН2 Атомы углерода в молекуле этилена образуют двойную связь, находятся в состоянии SP гибридизации

Связи в этилене неравноценны: (сигма) – более прочная (пи) – легче рвется, более реакционноспособна, плотность электронного облака максимально сконцентрирована «над» и «под» плоскостью сигма связи (боковое перекрывание)


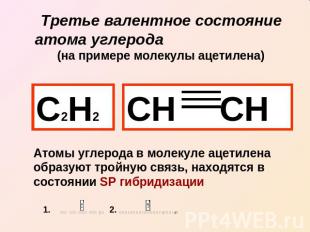
Третье валентное состояние атома углерода (на примере молекулы ацетилена) С2Н2 СН СН Атомы углерода в молекуле ацетилена образуют тройную связь, находятся в состоянии SP гибридизации
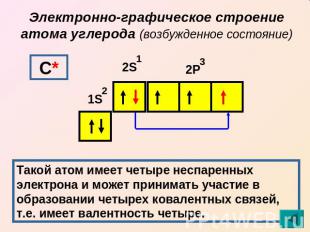
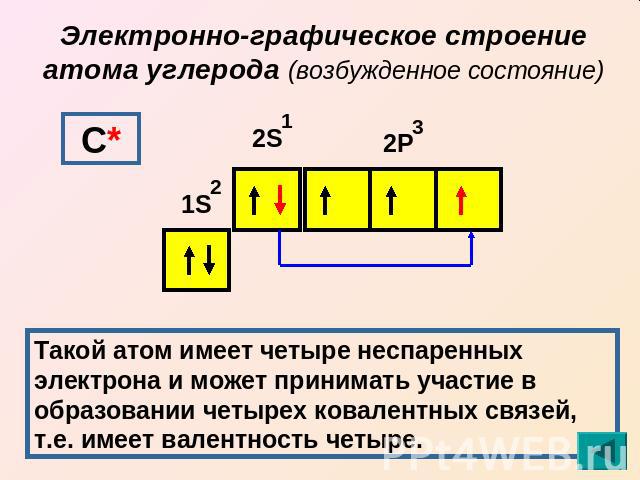
Электронно-графическое строение атома углерода (возбужденное состояние) Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей, т.е. имеет валентность четыре.
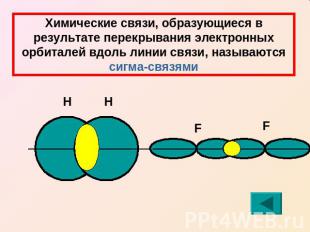
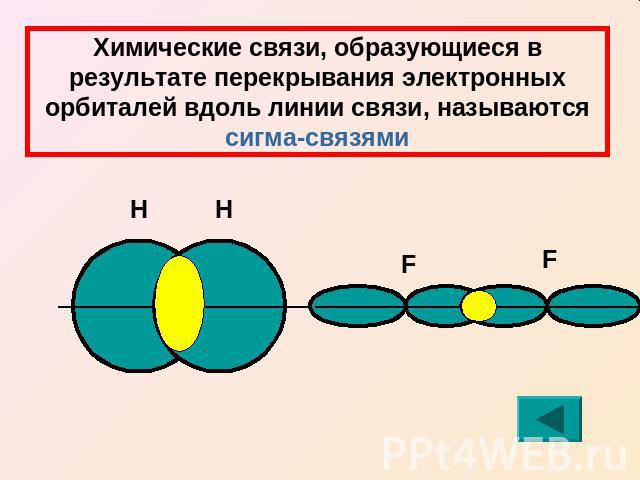
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связями
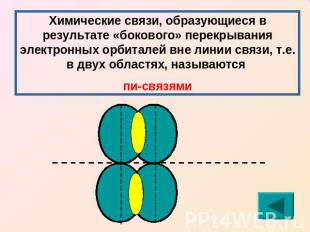
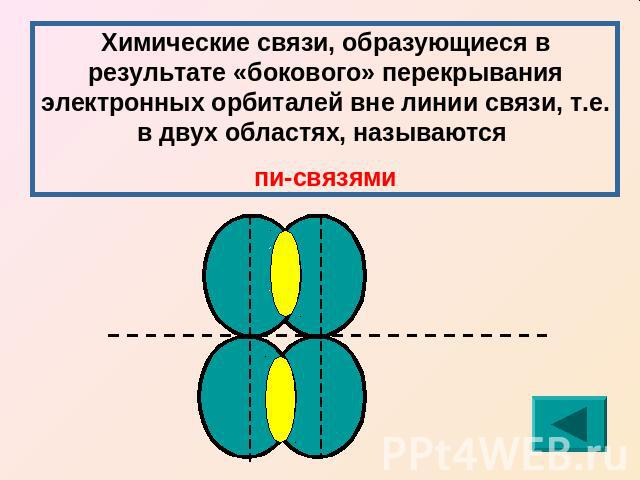
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются пи-связями