Презентация на тему: Кислоты в свете теории электролитической диссоциации

Кислоты в свете теории электролитической диссоциации.
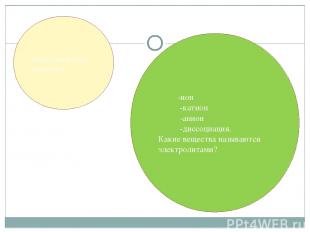
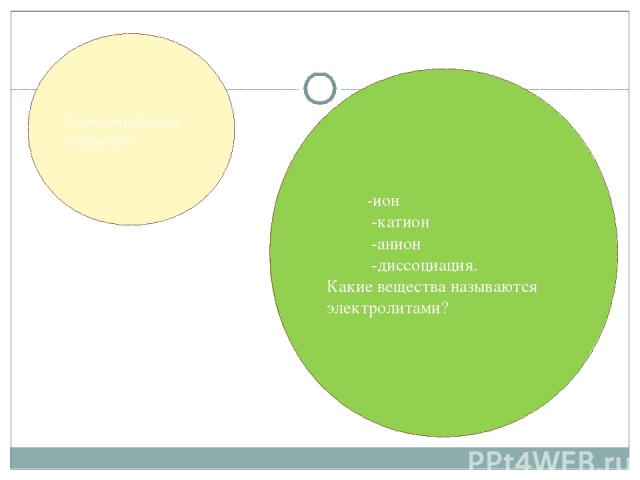
Дайте определение понятиям: -ион -катион -анион -диссоциация. Какие вещества называются электролитами?

Вещества, растворы которых проводят электрический ток, относятся к электролитам. Электролитами являются соли, кислоты и основания. Процесс распада электролита на ионы называется электролитической диссоциацией. Положительно заряженные ионы называют катионами (при помещении в раствор электродов движутся к отрицательно заряженному электроду - катоду). Отрицательно заряженные ионы называют анионами (движутся к положительно заряженному электроду - аноду

познакомиться с классификациями и общими химическими свойствами кислот в свете теории электролитической диссоциации. Цель урока:

Что мы узнаем? Как отличить кислоты от других веществ? Какие бывают кислоты? Какими свойствами обладают кислоты? Где применяются кислоты?

Чему мы научимся? Осуществлять химические реакции с участием кислот. Составлять уравнения этих реакций в молекулярной и ионной форме.
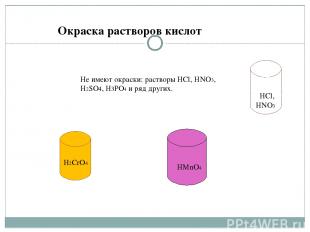
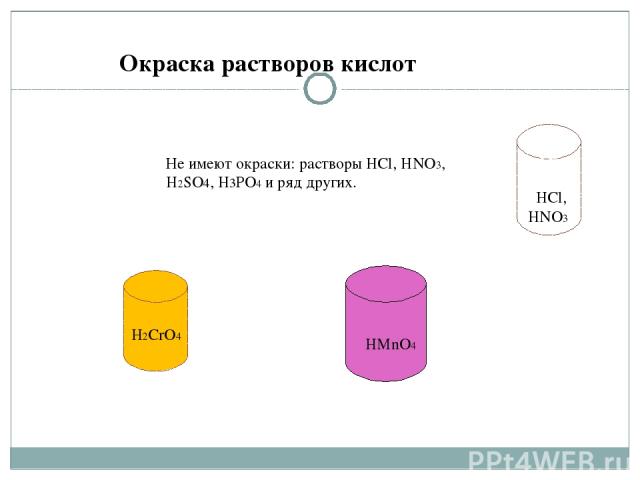
HCl, HNHOYYYY3 H2CrO4 HMnO4 Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и ряд других. Окраска растворов кислот HCl, HNO3
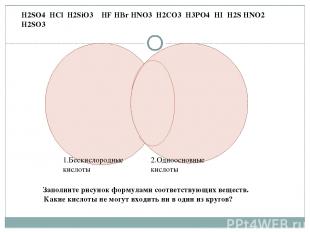
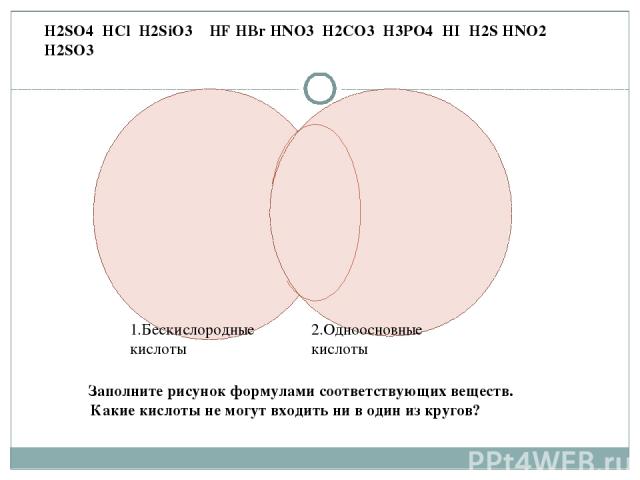
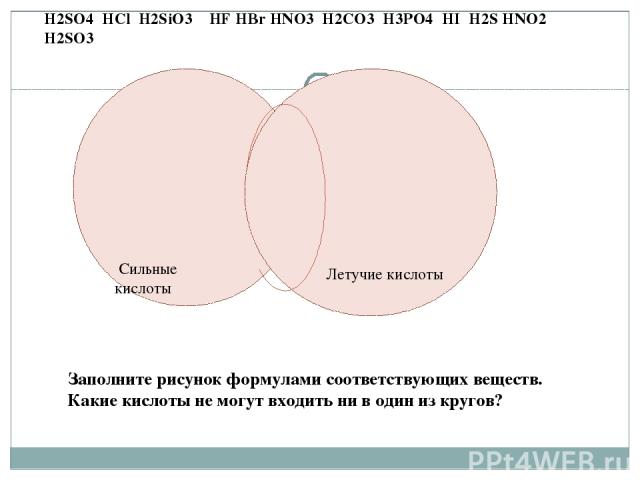
1.Бескислородные кислоты 2.Одноосновные кислоты H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO3 Заполните рисунок формулами соответствующих веществ. Какие кислоты не могут входить ни в один из кругов?
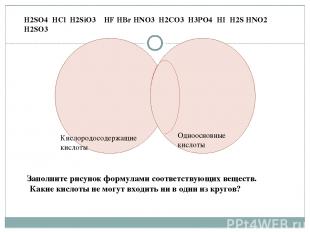
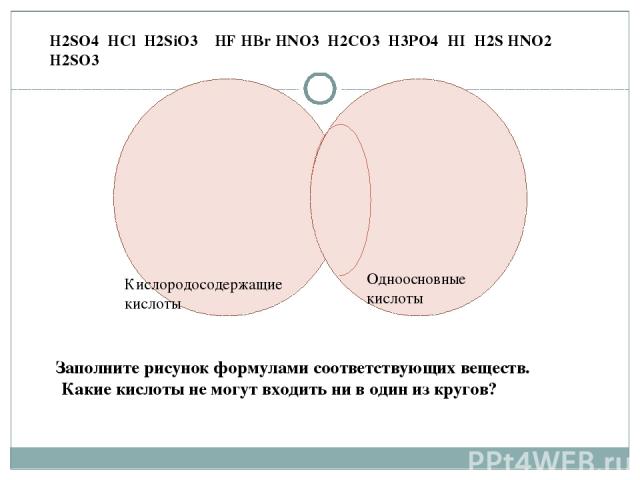
Кислородосодержащие кислоты Одноосновные кислоты H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO3 Заполните рисунок формулами соответствующих веществ. Какие кислоты не могут входить ни в один из кругов?

Сильные кислоты Летучие кислоты H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO3 Заполните рисунок формулами соответствующих веществ. Какие кислоты не могут входить ни в один из кругов?
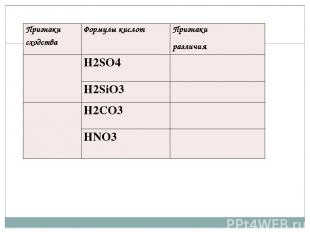
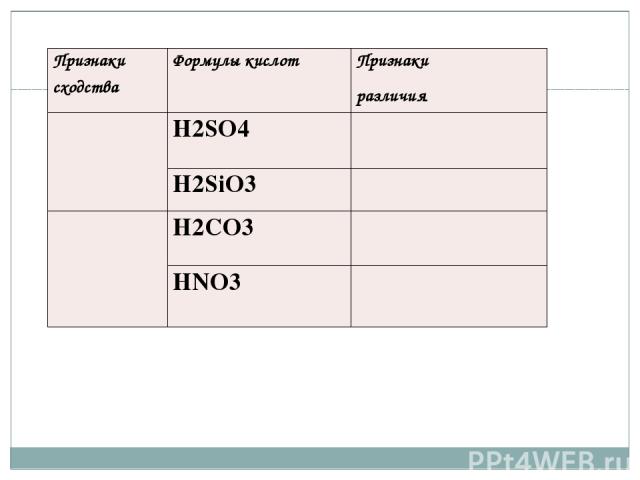
. Признакисходства Формулы кислот Признаки различия Н2SO4 H2SiO3 H2CO3 HNO3

Проделать реакции, характерные для кислот на примере серной кислоты, соляной кислоты. 2.Сделать вывод о химических свойствах кислот, 3.Закрепить навыки безопасного обращения с реактивами. Химические свойства кислот.



Вывод. Кислоты проявляют общие химические свойства и вступают в реакции с металлами, оксидами металлов, основаниями, солями.

Допишите возможные уравнения химических реакций в молекулярном и ионном виде: а) Н2SO4 + NaОН → б) Н2SO4 + Al2O3 → в) НСl + СаСО3 → 2. С какими из веществ будет взаимодействовать соляная кислота? а) НСl + СО2; → б) НСl + Ва(ОН)2→ в) НСl + K2SO4→ г) НСl + К2СО3→ Первичная проверка знаний

Закрепление Составьте краткий план-конспект «Химические свойства кислот в свете теории электролитической диссоциации» - Напишите уравнения реакций в полном и сокращенном ионном виде. - Чем обусловлены общие химические свойства кислот в свете теории электролитической диссоциации? Cтр156. последний абзац Перечислите все вещества, с которыми вступают в реакцию кислоты.

Подведение итогов урока: Что нового вы узнали сегодня о кислотах? Какие из изученных сегодня вопросов вызвали наибольшие трудности при усвоении? Как вы думаете, почему? Какие задания вам выполнить не удалось? Почему?

Выполните предложенные упражнения: С какими из перечисленных веществ может вступить во взаимодействие серная кислота, находящаяся в водном растворе: оксид магния, хлорид бария, серебро, оксид углерода (IV), алюминий, гидроксид калия, нитрат натрия? Напишите уравнения осуществимых реакций в молекулярном и ионном видах. Укажите тип реакции. Домашнее задание

Спасибо за внимание

Литература Литература. 1. Габриелян О.С. Химия 9 класс. Москва. 2002 Дрофа 2. Габриелян О.С., Остроумов И.Г. Настольная книга для учителя 9 класс. Москва. 2003 Дрофа 3. Габриелян О.С, Яшукова А.В. Методическое пособие 8-9 классы. Москва. 2004г. Дрофа. 4. Габриелян О.С., Решетов П.В.Остроумов И.Г. Задачи по химии и способы их решения 8-9классы. Москва. 2007г Дрофа 5. Горковенко М.Ю. Поурочные разработки по химии к учебникам Габриеляна О.С. 9класс Москва.2005. «ВАКО» ЭОР использованные по теме «Кислоты в свете ТЭД». № п/п Карточка ресурса 1 1. Классификация кислот http://files.school-collection.edu.ru/dlrstore/617fdbd0-8cff-11db-b606-0800200c9a66/ch08_38_01.swf 2 Правила техники безопасности при работе с кислотами http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf 3 Химические свойства кислот. http://files.school-collection.edu.ru/dlrstore/617fdbd1-8cff-11db-b606-0800200c9a66/ch08_38_02.swf Задание можно использовать для проверки усвоения новых знаний.