Презентация на тему: Гидролиз солей 9 класс

ГИДРОЛИЗ СОЛЕЙ9 класс

ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ

Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия «гидролиз» научиться объяснять химические процессы, протекающие в водных растворах солей записывать уравнения реакций гидролиза предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.

«ГИДРОЛИЗ» - от греческого «гидро» - вода«лизис» - разложение
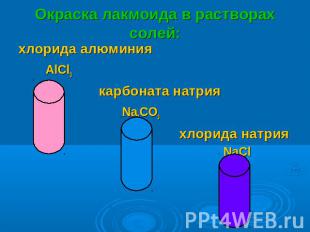
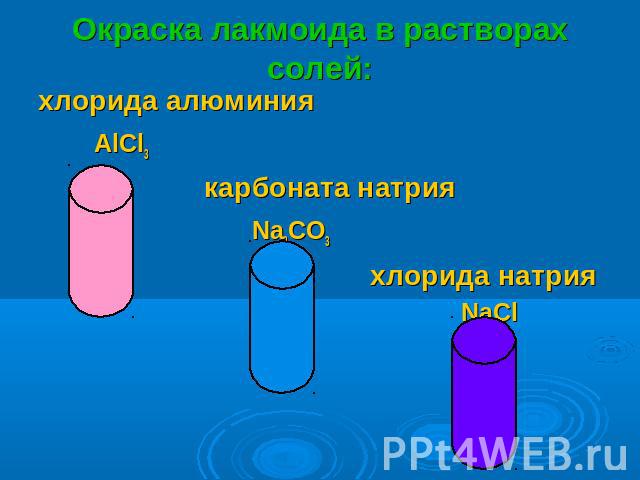
Окраска лакмоида в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl

ОКРАСКА ЛАКМОИДАВ РАСТВОРАХ СОЛЕЙ

Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al OH2- +H+ + 3Cl-
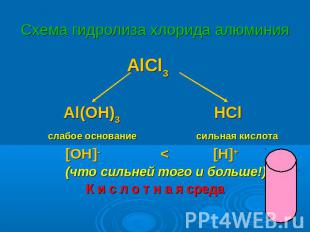
Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда

АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

Al3+ + HOH AlOH2+ + H+AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной обменной реакции является основная соль. Сформулируем вывод: Раствор соли, образованной ________________, имеет _____________реакцию, так как в растворе избыток___________________.

Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
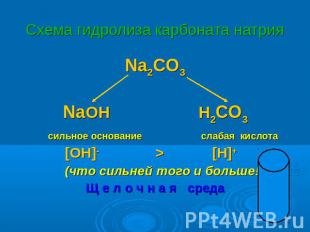
Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда

АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

CO32- +HOH HCO3- +OH-Na2CO3 +H2O NaHCO3 +NaOHОдним из продуктов данной обменной реакции является кислая соль. Сформулируем вывод: Раствор соли, образованной ________________, имеет__________реакцию, так как в растворе избыток ________________.

Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
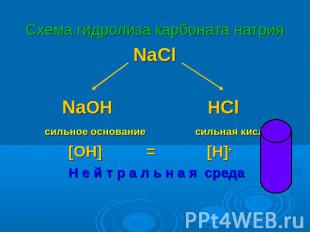
Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда

NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.

Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют? В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили

ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
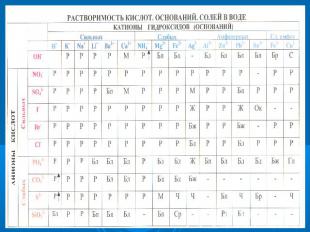

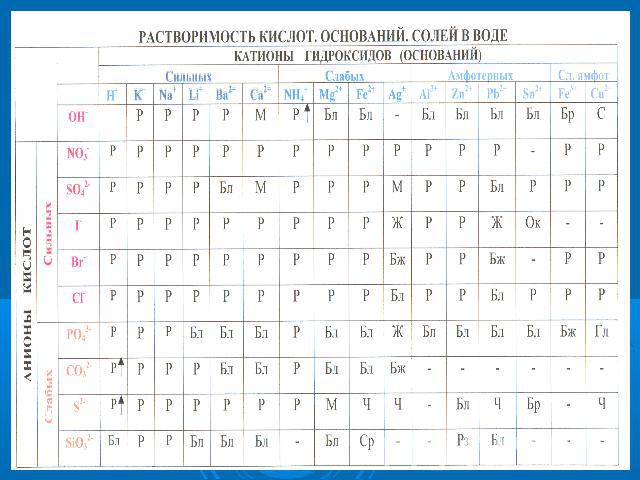
Самостоятельно заполните таблицу

Самостоятельно заполните таблицу

Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды

Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи) Очистка промышленных стоков и питьевой воды (сульфат алюминия + вода гидроксид алюминия) Подготовка тканей к окрашиванию Известкование почв основано на гидролизе

Роль гидролиза в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения

Ключ к оценке качества выполнения теста: Верные ответы: 1 вариант: 1а, 2б, 3а, S2- + HOH HS- + OH- 2 вариант: 1б, 2в, 3б, Mg2+ + HOH MgOH+ + H+ Ключ к оценке качества выполнения теста: «5» - 0 ошибок; «4» - 1 ошибка; «3» - 2 ошибки.

Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия «гидролиз» научиться объяснять химические процессы, протекающие в водных растворах солей записывать уравнения реакций гидролиза предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.

Урок окончен, всем спасибо!







![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда](/images/150/7972/640/img8.jpg)



![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда](/images/150/7972/640/img12.jpg)



![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда](/images/150/7972/640/img16.jpg)