Презентация на тему: Гидролиз солей



сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: , NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO3, H2CO3, H2SiO3, HF, HNO2, СН3СООН


Любую соль можно представить как продукт взаимодействия основания с кислотой. Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты можно выделить 4 типа солей:

1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 2. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, КСN, NaCH3COO). 3. Соли, образованные слабой кислотой и слабым основанием (NH4CN, Cu(CH3COO)2). 4. Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, BaI2).

Гидролизу подвержены соединения различных классов. Рассмотрим один случай – гидролиз солей.
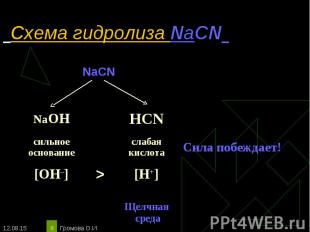

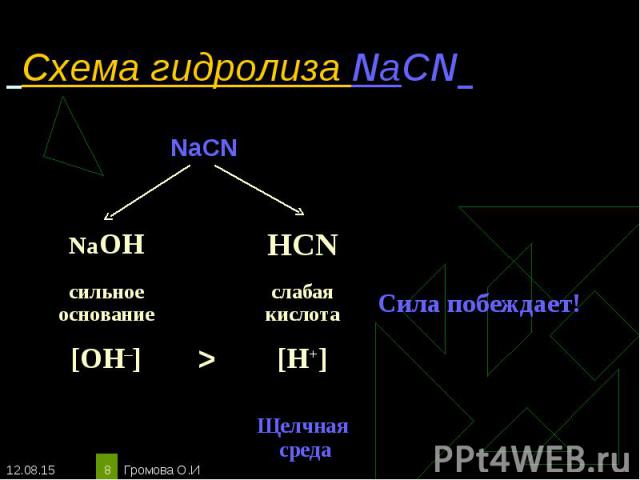
NaCN ↔Na+ + CN‾ NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ + H+ ____________________________ Полное ионное уравнение гидролиза: Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN Сокращённое уравнение гидролиза: CN¯ + Н2О ↔ OH¯ + HCN Полное молекулярное уравнение гидролиза: NaCN + Н2О ↔ NaOH + HCN Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым. рн >7, среда щелочная, гидролиз по аниону.
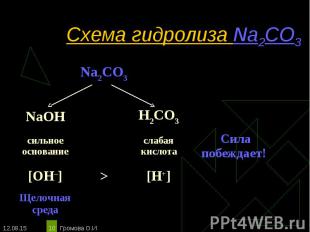

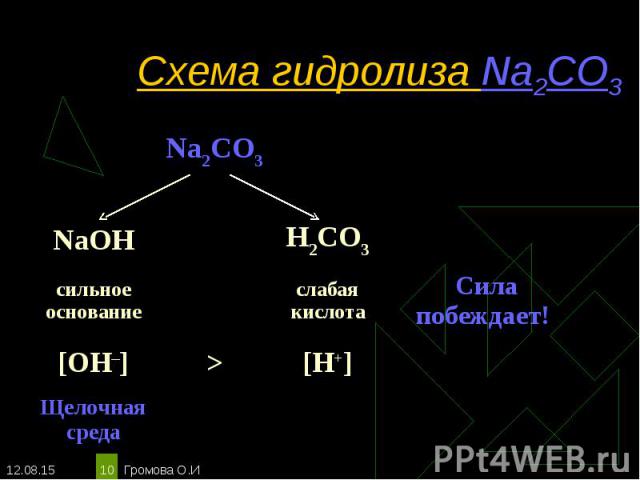
Na2CO3 ↔ 2Na+ + СO32– Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Полное ионное уравнение гидролиза: 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– Сокращённое уравнение гидролиза: СO32– + Н2O ↔ НСO3– + ОН– Полное молекулярное уравнение гидролиза: Na2CO3 + Н2O ↔ 2NaHCO3 + NaОН Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым. рн >7, среда щелочная, гидролиз по аниону.
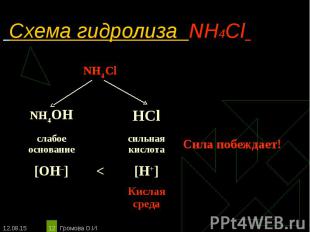

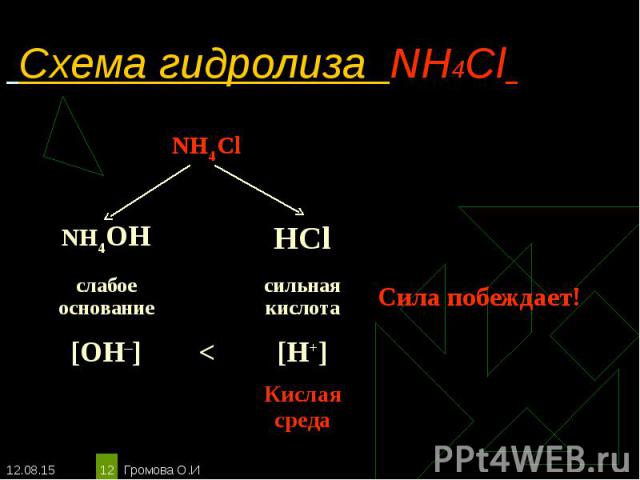
NH4Cl ↔ NH4+ + Сl– NH4Cl ↔ NH4+ + Сl– Н2O ↔ Н+ + ОН– _________________________________________ Полное ионное уравнение гидролиза: NH4+ + Сl– + Н2O ↔ NH3·H2О + Сl– + Н+ Сокращённое уравнение гидролиза: NH4+ + Н2O ↔ NH3·H2О + Н+ Полное молекулярное уравнение гидролиза: NH4Cl + Н2O ↔ NH3·H2О + НСl Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет. рн < 7, среда кислотная, гидролиз по катиону.


АlСl3 ↔ Аl3+ + 3Сl– АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ______________________________________ Полное ионное уравнение гидролиза: Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Сокращённое уравнение гидролиза: Аl3+ + Н2O ↔ АlOН2+ + Н+ Полное молекулярное уравнение гидролиза: АlСl3 + Н2O ↔ АlOНСl + НСl Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет. рн < 7, среда кислотная, гидролиз по катиону.


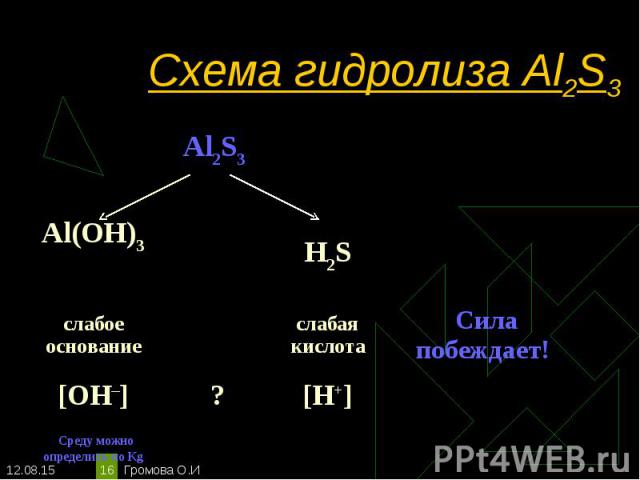
Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону.
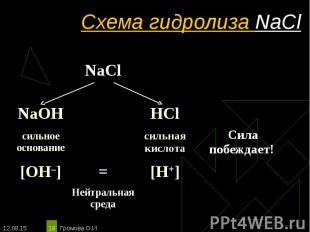

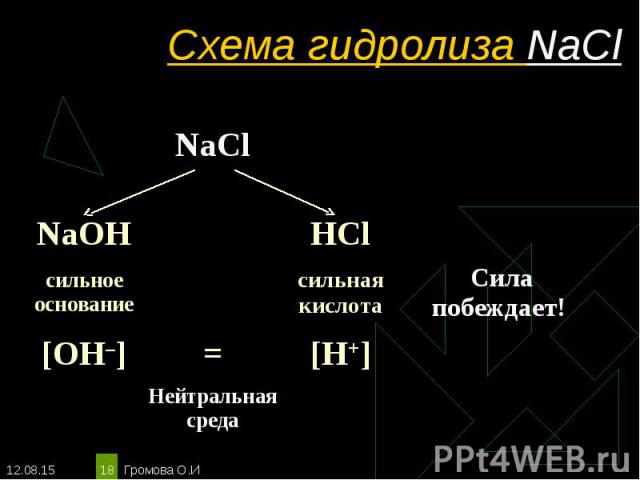
NaCl ↔ Na+ + Сl– NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается). рн =7, среда нейтральная, гидролиз не происходит.

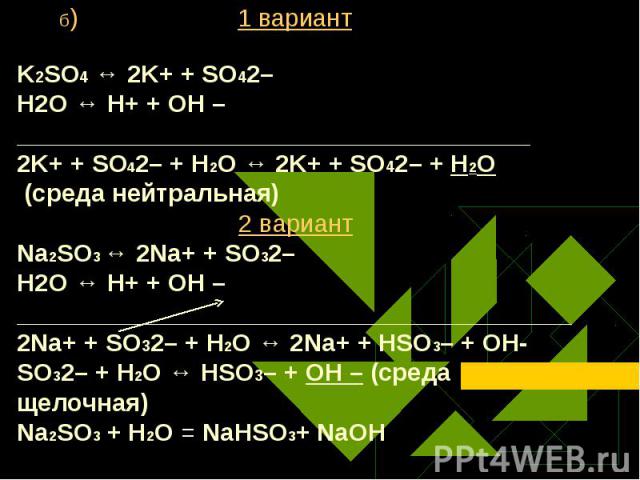
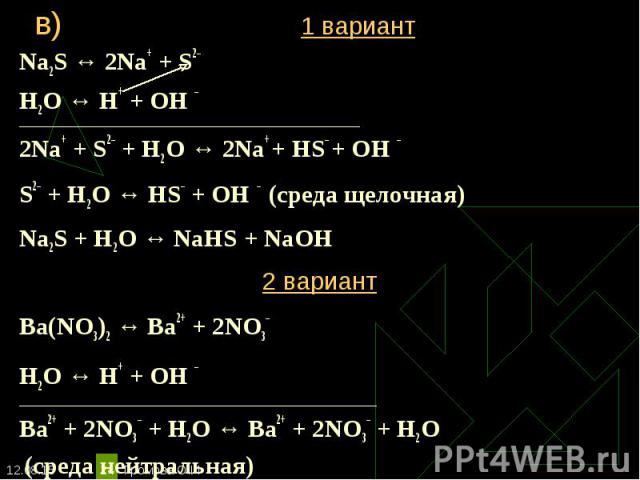
Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей.

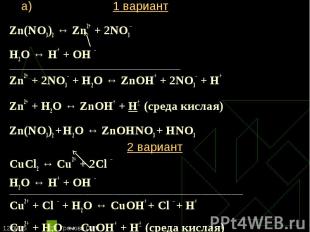
Zn(NO3)2 ↔ Zn2+ + 2NO3– Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+ Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая) Zn(NO3)2 + Н2O ↔ ZnOНNO3 + НNO3 2 вариант CuCl2 ↔ Cu2+ + 2Сl – Н2O ↔ Н+ + ОН – _______________________________________________________________________________________________________________________ Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+ Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая) CuCl2 + Н2O ↔ CuOHCl + НCl
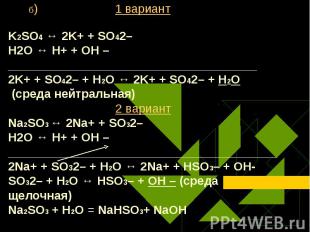
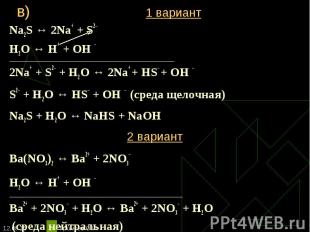
Na2S ↔ 2Na+ + S2– Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– + Н2O ↔ 2Na+ + HS– + ОН – S2– + Н2O ↔ НS– + ОН – (среда щелочная) Na2S + Н2O ↔ NaHS + NaОН 2 вариант Ba(NO3)2 ↔ Ba2+ + 2NO3– Н2O ↔ Н+ + ОН – ___________________________________________________________________ Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O (среда нейтральная)





Параграф 18, № 1-11. Параграф 18, № 1-11. В контакте. Ru, в заметках, материал ЕГЭ выполнить.

Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен, 2001. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен, 2001. Хомченко Г.П. , Хомченко И.Г. Сборник задач по химии. — М., 2000 . http://hydorlysis.narod.ru/pages/teoria.htm http://www.xumuk.ru/encyklopedia/1047.html