Презентация на тему: Газообразные вещества

Проект по химии «Газообразные вещества» 5klass.net

Рис.1. Агрегатные состояния воды: а – твёрдое; б – жидкое; в - газообразное Большинство веществ в зависимости от условий могут находиться в одном из трех фазовых, или агрегатных, состояний: газообразном, жидком или твердом. Например, вода встречается в трех агрегатных состояниях (рис. 1): жидкая, твердая (лед) и газообразная (водяной пар). В газовой фазе расстояние между атомами или молекулами во много раз превышает размеры самих частиц. При атмосферном давлении объем сосуда в сотни тысяч раз больше собственного объема молекул газа, поэтому для газов выполняется закон Авогадро:

В газовой фазе расстояние между атомами или молекулами во много раз превышает размеры самих частиц. При атмосферном давлении объем сосуда в сотни тысяч раз больше собственного объема молекул газа, поэтому для газов выполняется закон Авогадро: Из этого закона вытекает важное следствие: 1 моль лю бого газа при нормальных условиях (760 мм рт. ст. и 0 °С) занимает объем 22,4 л. Этот объем, как вы знаете, называют молярным объемом газов (Vм = 22,4 л/моль). Слабые силы притяжения молекул газа не могут удержать их друг около друга, поэтому газы не имеют собственной формы и объема, а занимают весь объем сосуда, в котором находятся. Газы легко сжимаются. При этом изменяется межмолекулярное расстояние. Благодаря большому расстоянию между молекулами любые газы смешиваются друг с другом в любых соотношениях. Важнейшими природными смесями газов являются воздух и природный газ. Состав воздуха в настоящее время относительно постоянен, он складывался миллионы лет благодаря фотосинтезу, осуществляемому растениями. Историю возникновения и развития атмосферы Земли можно представить в виде схемы(Рис. 2) В отличие от воздуха, состав другой естественной смеси, сформировавшейся в недрах Земли, — природного газа зависит от месторождения. Тем не менее основу его составляют предельные углеводороды: метан и его гомологи (этан, пропан и бутан). Мудрая природа разместила эти газовые смеси на планете относительно изолированно друг от друга. Если же произойдет их перемешивание, это может закончиться катастрофой, что нередко происходит при несоблюдении правил техники безопасности в шахтах, рудниках, местах . Природный газ — это не только дешевое, экологиче ски чистое, энергетически и экономически выгодное топливо, но также и ценное химическое сырье. Один из продуктов переработки природного газа — это водород.

Рис. 2 История возникновения и развития атмосферы на Земле.

Водород Водород Н2 — это самый легкий газ, который исполь зуют для производства аммиака, хлороводорода, получе ния маргарина, водородной резки и сварки металлов, в качестве топлива для двигателей космических кораблей (рис. 3). Водород — это перспективное экологически чистое автомобильное топливо. В лаборатории водород получают чаще всего в аппарате Киппа(Рис. 4) взаимодействием цинка с соляной кислотой: Так как водород самый легкий из газов, его собирают в перевернутый вверх дном сосуд. Определяют чистоту водорода по характерному звуку взрыва его небольшого количества. Этот эффект может быть разным: глухой хлопок, если в сосуде находился чистый водород, и характерный «лающий» звук, если водород содержал примесь воздуха (Рис. 5). Смесь двух объемов водорода и одного объема кислорода называют гремучим газом, так как она при поджигании взрывается.

Рис.3 Водород – топливо космических кораблей Рис.4 Аппарат Киппа Рис.5 Проверка водорода на чистоту

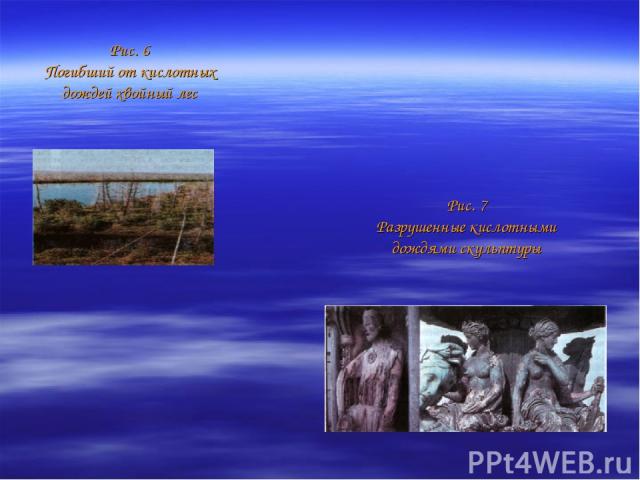
Кислород Кислород 02, как вы уже знаете, составляет 21% ат мосферы. Кроме кислорода, в верхних слоях атмосферы содержится аллотропное видоизменение кислорода — озон 03. Атмосферный озон интенсивно поглощает ультрафиолетовые лучи. Таким образом, озоновый слой защищает жизнь на Земле от их губительного воздействия. Вместе с тем атмосфера пропускает инфракрасное излучение Солнца. Атмосфера, благодаря содержащемуся в ней озону, углекислому газу и водяному пару, малопроницаема для инфракрасного излучения Земли. Если бы эти газы не содержались в атмосфере, Земля превратилась бы в безжизненный шар, средняя температура на по верхности которого была бы —23 °С, в то время как фактически она равна +14,8 °С. Состав атмосферы может изменяться в результате антропогенного (вызванного деятельностью человека на природу) загрязнения. Например, оксиды серы и азота образуют в атмосфере азотную и серную кислоты, которые выпадают в виде кислотных дождей и вызывают гибель растений и животных (Рис. 6). Они наносят большой вред архитектурным и скульптурным памятникам (Рис. 7), разрушают металлические крыши и конструкции — мосты и опоры.

Рис. 6 Погибший от кислотных дождей хвойный лес Рис. 7 Разрушенные кислотными дождями скульптуры

Искусственное загрязнение окружающей среды оказывает косвенное воздействие на атмосферу, изменяя ее свойства. Так, в результате увеличивающегося сжигания топлива и уменьшения площадей, занятых растительностью, фотосинтетическое восстановление кислорода из углекислого газа в настоящее время уменьшилось на 30% за последние 10 тыс. лет. Ежегодная убыль кислорода составляет 31,62 млрд т. Если учесть, что в атмосфере содержится 1200 трлн. т кислорода, то его количество в атмосфере за год уменьшается на 0,0025%. Казалось бы, это немного, но, очевидно, в конце концов может встать воп рос о введении ограничений на потребление кислорода. Накопление в атмосфере углекислого газа и других веществ в атмосфере — причина парникового эффекта. Рассмотрим это явление. Максимальная концентрация озона в атмосфере наблюдается на высоте 20—25 км. Известно, что озон поглощает ультрафиолетовые лучи. При этом он сильно разогревается и препятствует потере тепла нижними слоями атмосферы. Помимо этого, озон, как и углекислый газ, поглощает инфракрасное излучение Земли. Следовательно, озон не только спасает все живое на Земле от ультрафиолетовых лучей, но вместе с углекислым газом играет важную роль в тепловом балансе атмосферы Земли. Парниковый эффект приводит к глобальному потеплению климата. Чтобы понять, как оно возникает, вспомните, как нагревается автомобиль изнутри, когда он стоит с закрытыми окнами на солнце. Солнечный свет проникает через стекла и поглощается сиденьями и другими предметами салона. При этом световая энергия превращается в тепловую, которую предметы отражают в виде инфракрасного излучения. В отличие от света, оно почти не проникает сквозь стекла наружу, т. е. остается внутри автомобиля. За счет этого повышается температура. То же самое происходит и в парнике, отчего и произошел термин «парниковый эффект».

Рис. 8 Кислород необходим для дыхания Атмосфера — это не только среда, в которой мы живём. Воздух атмосферы служит основным источником получения кислорода в промышленности. Области при менения кислорода можно охарактеризовать двумя словами — дыхание (рис. 8) и горение (рис. 9). Рис. 9 Кислород поддерживает горение

Рис. 10 Получение кислорода в лаборатории разложением перманганата калия и собирание его методом вытеснения воздуха В лаборатории кислород получают разложением перманганата калия (рис. 10) или пероксида водорода (рис.11): Рис. 11 Получение кислорода в лаборатории разложением пероксида водорода и собирание его методом вытеснения воды

Углекислый газ Углекислый газ С02 - широко применяют для изготовления шипучих напитков, тушения пожаров и получения «сухого льда», который используют для охлаждения и хранения продуктов питания, в первую очередь мороженого (рис. 12). В промышленности углекислый газ получают обжигом известняка: В лаборатории оксид углерода (IV) получают действием соляной кислоты на мрамор: Собирают углекислый газ в сосуд методом вытеснения воздуха, так как оксид углерода (IV) почти в 1,5 раза тяжелее его (рис. 13).

Рис. 12 Применение углекислого газа: 1 – тушение пожара; 2 – хранение мороженного; 3 – производство шипучих напитков; 4 – создание спецэффектов на сцене. Рис. 13 Углекислый газ собирают в сосуд методом вытеснения воздуха

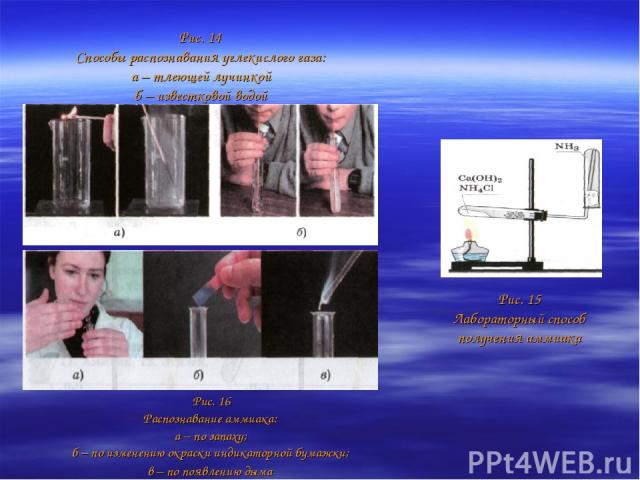
Распознают углекислый газ или с помощью горящей лучинки, которая гаснет в его атмосфере (углекислый газ не поддерживает горение) (рис. 14, а), или по помутнению известковой воды (рис. 14, б): Из воздуха получают не только кислород, но и азот, который вместе с водородом служит сырьем для получения ценного газообразного продукта — аммиака NH3: В лаборатории аммиак получают взаимодействием щелочей с солями аммония (рис. 15) Аммиак легче воздуха, поэтому его собирают методом вытеснения воздуха в перевернутый вверх дном сосуд. Распознают аммиак тремя способами: а) по запаху; б) по изменению окраски влажной лакмусовой бумажки (с красного цвета на синий); в) по появлению дыма при поднесении стеклянной палочки, смоченной соляной кислотой (рис. 16). Природный газ служит сырьем для получения ценных газообразных органических соединений, например этилена.
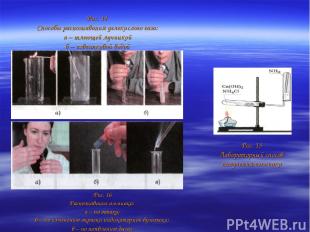
Рис. 14 Способы распознавания углекислого газа: а – тлеющей лучинкой б – известковой водой Рис. 16 Распознавание аммиака: а – по запаху; б – по изменению окраски индикаторной бумажки; в – по появлению дыма Рис. 15 Лабораторный способ получения аммиака

Этилен Этилен (С2Н4, или СН2=СН2) применяют для получения других органических соединений (рис. 17). В промышленности этилен получают дегидрированием этана: Рис. 17. Применение этилена: 1 – в овощехранилищах для ускорения созревания плодов; 2 – 6 – производство органических соединений (полиэтилена 2, растворителей 3, уксусной кислоты 4, спиртов 5, 6)

В лаборатории этилен получают двумя способами: деполимеризацией полиэтилена (рис. 18, а) или каталитической дегидратацией этилового спирта (рис. 18, б). В качестве катализатора используют белую глину или чистый оксид алюминия: Распознают этилен по обесцвечиванию подкисленного раствора перманганата калия или бромной воды (рис. 19).

Рис. 18 Лабораторные способы получения этилена: а – деполимеризация полиэтилена; б – каталитическая дегидратация этилового спирта

Рис. 19 Распознавание этилена с использованием: а – раствора перманганата калия; б – бромной воды.

Выполнили: Учащиеся 9а класса Проверил: Учитель химии Гащенко Н. Г.