Презентация на тему: электролиз. удивительный мир гальваники

за счет электрической энергии осуществляются химические реакции - восстановления катионов на катоде (-) - окисления анионов на аноде (+), которые не могут протекать самопроизвольно. это совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.

ХАРАКТЕРИСТИКА: энергетически ёмкий (электролиты плавятся при очень высоких температурах); при плавлении разрушаются кристаллические решётки; в расплаве беспорядочно двигаются не гидратированные ионы. ПРИМЕНЕНИЕ: Электролиз расплава солей или оксидов – для получения высокоактивных металлов (калия, алюминия и др.), легко вступающих во взаимодействие с водой.

Примеры электролиза расплавов NaCl K(-): Na ++ 1e → Na0 A(+): 2Cl- - 2e → Cl2 2NaCl → 2Na + Cl2 2. FeF3 K(-): Fe3+ + 3e → Fe0 | 2 A(+): 2F- - 2e → F20 | 3 2FeF3 → 2Fe + 3F2 3. Na2SO4 K(-): 2Na+ + 2e → 2Na0 | 2 A(-): 2SO42- - 4e → 2SO3 + O2 2Na2SO4 → 4Na + 2SO3 + O2 4. Na2CO3 K(-): 2Na+ + 2e → 2Na0 | 2 A(-): 2CO32- - 4e → 2CO2 + O2 2Na2CO3 → 4Na + 2CO2 + O2 5. KOH K(-): K+ +1e → K0 | 4 A(+): 4OH- - 4e → O2 + 2H20 4KOH → 4K + O2 + 2H2O

процесс более энергетически выгодный, чем электролиз расплавов при электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы при выборе наиболее вероятного процесса на аноде и катоде исходят из положения, что протекает та реакция, которая требует наименьшей затраты энергии.

Li K Rb Ba Ca Na Mg Al| Mn Zn Cr Fe Cd Co Ni Sn Pb H| Cu Hg Ag Pt Au Чем правее металл (больше алгебраическое значение электродного потенциала), тем меньше энергии расходуется на разрядку его ионов. Если в растворе катионы Cu2+, Hg2+, Ag+, то последовательность выделения на катоде: Ag+, Hg2+, Cu2+ и только после исчезновения в растворе ионов металлов начнется разрядка ионов Н+.

Li K Rb Ba Ca Na Mg Al | Mn Zn Cr Fe Cd Co Ni Sn Pb H | Cu Hg Ag Pt Au Только: 2H2O + 2e H2 + 2OH- (в нейтральной, щелочной) 2H+ + 2e H2 (в кислой среде) (Меn+ - в растворе ) Одновременно: Меn+ + nе Ме0 2H2O + 2e H2 + 2OH- Меn+ + nе Ме0 (без восстановления воды) не зависят от материала катода, зависят от положения металла в ряду напряжений

ПРОЦЕССЫ НА АНОДЕ: с растворимым анодом с нерастворимым анодом (поведение кислородсодержащих и бескислородных кислотных остатков) зависят от материала анода и от природы аниона

Электролиз растворов солей с анодом (Cu, Zn, Fe, Ag и др.): - не зависит от аниона соли, окисление материала анода (его растворение), перенос металла с анода на катод, концентрация соли в растворе не меняется. Пример: электролиз раствора (CuCl2, КCl, CuSO4) с медным анодом на аноде, вместо разрядки ионов (Сl- и выделения хлора) протекает окисление анода (Cu0→ Cu2+ в раствор), на катоде выделяется медь. А (+) Cu0 - 2e = Cu2+ К (-) Cu2+ + 2e = Cu0 Применение: при рафинировании (очистке) металлов от загрязнений, гальваностегии, гальванопластике. Конкурирующие реакции на электродах : на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла (материала анода); на катоде — восстановление катиона соли и Н+, восстановление катионов Меn+, полученных при растворении анода

Конкурирующие процессы при электролизе с инертным анодом (графит, платина) – два окислительных и восстановительных процесса: на аноде — окисление анионов и ОН-, на катоде — восстановление катионов и ионов Н+. В ряду ( ) уменьшается восстановительная активность анионов (способность отдавать электроны): I-, Br-,S2-, Cl-, OH-, SО42-, NO3-, РO43-, F-. ПРАВИЛА Анионы кислородсодержащих кислот ( SО42-, NO3-, РO43-, а также F- и ОН-) – не окисляются, а окисляются молекулы воды, выделяется кислород: 2H2O – 4 e O2 + 4H+, 4ОН- - 4е O2 + 4H2О. 2. Анионы бескислородных кислот (галогенид-ионов) – окисляются без окисления воды (выделяются свободные галогены): Асm- - me Ac0. 3. При окислении анионов органических кислот происходит процесс: 2 RCOO- - 2е → R-R + 2СО2.

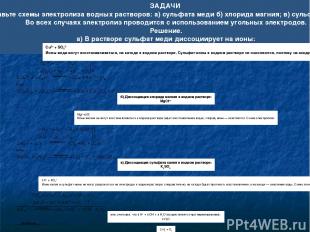
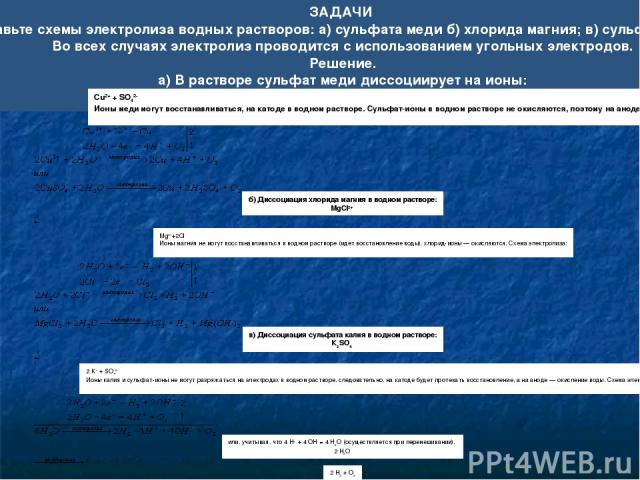
Пример 1. Разряжается анион соли и вода: а) электролиз раствора NaCl: К(-): 2H2O + 2e H2 + 2OH- А(+): 2Cl- - 2e Cl20 Итог: 2NaCl + 2H2O Cl2 + H2 + 2NaOH б) электролиз раствора MgCl2: К(-): 2H2O + 2e H2 + 2OH- А(+): 2Cl- - 2e Cl20 Итог: MgCl2 + 2H2O Cl2 + H2 + Mg(OH)2 в) электролиз раствора CaI2: К(-): 2H2O + 2e H2 + 2OH- А(+): 2I- - 2e I20 Итог: CaI2 + 2H2O l2 + H2 + Ca(OH)2

Пример 2. Разряжаются катион и анион соли: электролиз раствора CuCl2: К(-): Cu2+ + 2e Cu0 А (+): 2Сl- - 2e Cl20 Итог: CuCl2 Cu + Cl2

Пример 3. Разряжаются катион соли и вода: а) электролиз раствора ZnSO4 К(-): Zn2+ + 2e Zn0 2H2O +2e H2 + 2OH- А(+): 2H2O – 4e O2 + 4H+ Итог: ZnSO4 + H2O Zn + H2 + O2 + H2SO4 б) электролиз раствора CuSO4: К(-): Cu2+ + 2e Cu0 | 2 А(+): 2H2O – 4e O2 + 4H+ Итог: 2CuSO4 +2 H2O 2Cu + O2 + 2H2SO4 в) электролиз раствора Cu(NO3)2: К(-): Cu2+ + 2e Cu0 | 2 А(+): 2H2O – 4e O2 + 4H+ Итог: 2Cu(NO3)2 +2 H2O 2Cu + O2 + 4HNO3 г) электролиз раствора FeF3: К(-): Fe3+ + 3e Fe0 | 4 А(+): 2H2O – 4e O2 + 4H+ | 3 Итог: 4FeF3 + 6H2O 4Fe + 3O2 + 12HCl д) электролиз раствора AgNO3: К(-): Ag+ + 1e Ag0 | 4 А(+): 2H2O – 4e O2 + 4H+ Итог: 4AgNO3 + 2H2O 4Ag + O2 +4HNO3

Пример 4. Разряжается только вода: Электролиз раствора Na2SO4, KNO3 К(-): 2H2O + 2e H2 + 2OH- | 2 А(+): 2H2O – 4e O2 + 4H+ Итог: 2H2O 2H2 + O2 При электролизе водного раствора соли активного металла кислородсодержащей кислоты (например, КNО3) ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород, а на аноде — кислород, и электролиз раствора нитрата калия сводится к электролитическому разложению воды. Пример 5. Электролиз растворов щелочей Раствор NaOH, KOH: K(-): 2H2O + 2e → H2 + 2OH- | 2 A(+): 4OH- - 4e → O2 + 2H2O щелочная среда Итог: 4H2O + 4OH- 2H2 + O2 + 4OH- + 2H2O 2H2O 2H2 + O2

получение щелочей, хлора, водорода, алюминия, магния, натрия, кадмия очистка металлов (меди, никеля, свинца) защита от коррозии

Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается: m = (Э / F) · I · t = (М / (n · F)) · I · t, где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаем электронов; I — сила тока (А); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F= 96500 Кл/ моль = 26,8 А· ч / моль).

ЗАДАЧА Электролиз 400 г 8,5%-ного раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах. Решение: При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg+, а на аноде — окисление молекул воды: К(-): Аg+ + е = Аg0. А(+): 2 Н2О - 4е = 4 Н+ + О2. Суммарное уравнение: 4 AgNО3 + 2 Н2О = 4Ag↓ + 4 НNО3 + О2↑. По условию: (АgNО3) = 400 . 0,085 / 170 = 0,2 (моль). При полном электролитическом разложении данного количества соли: (Аg) = 0,2 моль, m(Аg) = 0,2 . 108 = 21,6 (г) (О2) = 0,05 моль, m(О2)= 0,05 . 32 = 1,6 (г). Общее уменьшение массы раствора за счет серебра и кислорода составит 21,6 + 1,6 = 23,2 (г).

При электролизе образовавшегося раствора азотной кислоты разлагается вода: 2 H2O = 2 Н2↑ + O2↑. Потеря массы раствора за счет электролиза воды: 25 - 23,2 = 1,8 (г). Количество разложившейся воды равно: v(Н20) = 1,8/18 = 0,1 (моль). На электродах выделилось: (Н2) = 0,1 моль, m(Н2)= 0,1 . 2 = 0,2 (г) (О2) = 0,1/2 = 0,05 (моль), m(О2)= 0,05 . 32 = 1,6 (г). Общая масса кислорода, выделившегося на аноде в двух процессах, равна: 1,6 + 1,6 = 3,2 г. В оставшемся растворе содержится азотная кислота: (НNO3) = (АgNО3) = 0,2 моль, m(НNО3) = 0,2 . 63 = 12,6 (г). Масса раствора после окончания электролиза: 400-25 = 375 (г). Массовая доля азотной кислоты: ω(НNО3) = 12,6/375 = 0,0336, или 3,36%. Ответ: ω(НNО3) = 3,36%, на катоде выделилось 21,6 г Аg и 0,2 г Н2, на аноде — 3,2 г О2.