Презентация на тему: Электролиз

Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных процессов примеры электролиза применение электролиза
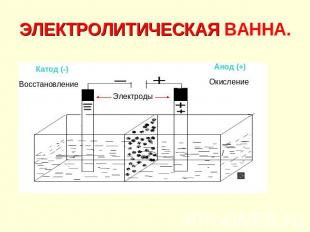
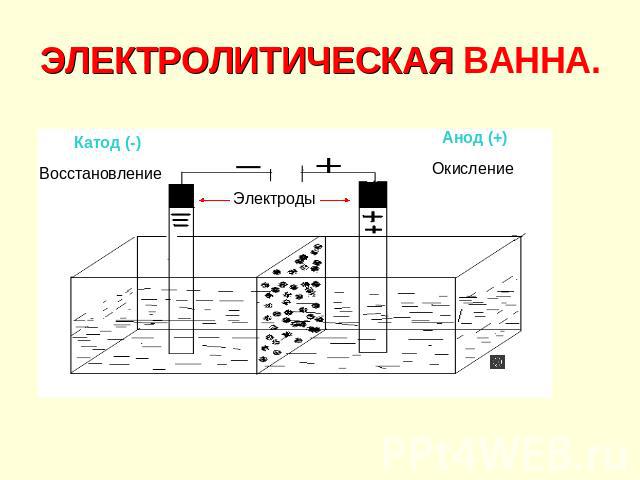
ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.

Электролиз. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиты: соли, щёлочи, кислоты.

Процессы на катоде 1. Катионы активных металлов: Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+, NH4+ Металлы не восстанавливаются, а восстанавливаются молекулы H2O: 2H2O + 2ē = H2↑ + 2OH–

Процессы на катоде 2. Катионы металлов средней активности Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+, Sn2+, Pb2+ Катионы металлов восстанавливаются совместно с молекулами воды: Men++ nē = Meo 2H2O + 2ē = H2↑+ 2OH–

Процессы на катоде 3. Катионы водородаH+ Ионы H+ восстанавливаются только при электролизе растворов кислот: 2H++ 2ē = H2↑

Процессы на катоде 4. Катионы малоактивных металлов: Cu2+, Hg2+, Ag+, Pt2+, Au3+ Восстанавливаются только катионы металлов: Men++nē = Meo

Процессы на аноде 1-2 1) Анионы бескислородных кислот: I–, Br–, S2–, Cl– Окисляются кислотные остатки Am– – mē = Ao 2) Анионы OH– Окисляются только при электролизе растворов щёлочей 4OH– – 4ē = O2↑+ 2H2O

Процессы на аноде 3-4. 3) Анионы кислородсодержащих кислот: SO42–, NO3–, CO32–, PO43– Окисляются молекулы воды: 2H2O – 4ē =O2↑+ 4H+ 4) Анионы F– Окисляются только молекулы воды 2H2O – 4ē = O2↑ + 4H+

Если анод растворимый Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлы. Анионы не окисляются. Окисляется сам анод: Мео – nē = Men+ Катионы Men+ переходят в раствор. Масса анода уменьшается.

Электролиз расплавов Расплав KOH = K+ + OH– (–) Катод: K+ + 1ē = Ko │х 4 (+) Анод: 4OH– – 4ē = O2↑+ 2H2O │х 1 4K++ 4OH– = O2↑ + 2H2O↑+ 4K 4KOH → 4K + O2↑ + 2H2O↑

Электролиз раствора NaCl Раствор NaCl (–) Катод ← Na+ Cl– → (+) Анод H2O H2O (–) Катод: 2H2O + 2ē = H2↑+ 2OH– (+) Анод: 2Cl– – 2ē = Cl2↑ 2H2O + 2Cl– = H2↑ + Cl2↑ + 2OH– 2H2O+2NaCl=H2↑+Cl2↑+ 2NaOH

Если анод растворимый Анод растворимый. Электролиз раствора AgNO3 (анод растворимый – из Ag) (–) Катод: Ag+ + 1ē = Ago (+) Анод: Ago – 1ē = Ag+ Ago + Ag+ = Ag+ + Ago Электролиз сводится к переносу серебра с анода на катод.

Законы электролиза. Законы Фарадея. Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через электролит: где , m–масса веществ продуктов электролиза, гр. Э – эквивалентная масса вещества, гр. I – сила тока, А. F – постоянная Фарадея = 96500 Кл. t – время электролиза, сек.

Применение электролиза. Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов Для получения точных металлических копий, что называется гальванопластикой Для защиты металлических изделий от коррозии и для придания декоративного вида. Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется ГАЛЬВАНОСТЕГИЕЙ.