Презентация на тему: Алкены. Строение. Изомерия. Химические свойства. Получение

Алкены. Строение. Изомерия. Химические свойства. Получение. Учитель химии ГОУ СОШ №277 Кировского района г. Санкт-Петербурга Елена Викторовна Переверзева

Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду равна 14. Решим задачу на нахождение молекулярной формулы органического вещества по массовым долям элементов и относительной плотности паров этого вещества. Составим структурную формулу искомого вещества.

Алкены (олефины, этилены) Непредельные углеводороды, в молекулах которых содержится одна двойная связь. Общая формула гомологического ряда алкенов CnH2n.
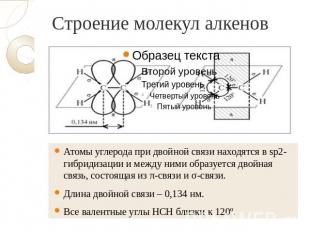
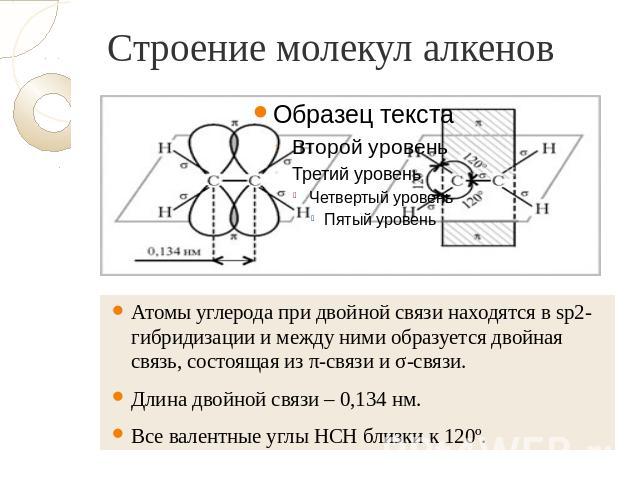
Строение молекул алкенов Атомы углерода при двойной связи находятся в sp2-гибридизации и между ними образуется двойная связь, состоящая из π-связи и σ-связи. Длина двойной связи – 0,134 нм. Все валентные углы НСН близки к 120º.
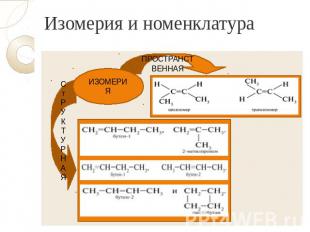
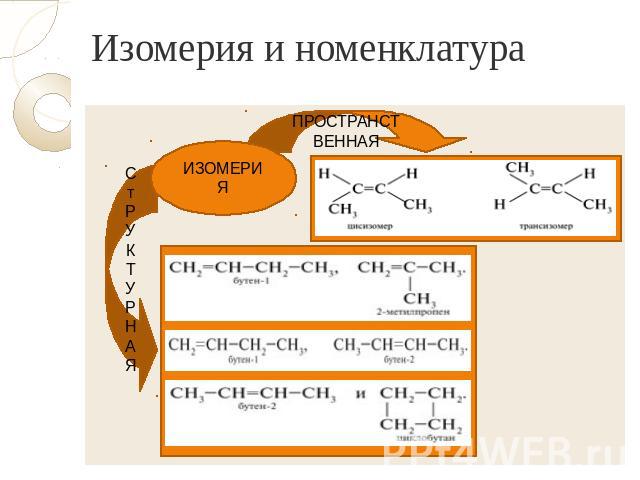
Изомерия и номенклатура

Тестовое задание № 1: 1. Ациклические углеводороды, в молекулах которых содержится одна двойная связь, называются А) алканы Б) алкены В) алкины Г) арены. 2. Для алкенов характерна изомерия А) углеродного скелета Б) положения кратной связи В) геометрическая Г) все ответы верны. 3. Формула 2,3-диметилпентена-1 А) СН2=СН−СН2−СН2−СН3 Б) СН3−С=С−СН2−СН3 | | | СН3 Н3С СН3 В) СН3−СН2−СН2−СН2−СН3 Г) СН2=С−СН−СН2−СН3 | | | | Н3С СН3 Н3С СН3

Химические свойства \ σ / \ σ / C==C + A—B → C — C / π \ / | | \ А В Алкены вступают в реакции электрофильного присоединения. При химической реакции π- связь легко разрывается и по линии разрыва происходит присоединение атомов или групп атомов.

Реакции присоединения Присоединение водорода: Н2С=СН2 + H2 → Н3С—СН3 Присоединение галогенов: Н2С=СН2 + Cl2 → ClH2C—CH2Cl Присоединение галогеноводородов: H2С=СН2 + НВr → Н3С—CH2Вr Присоединение воды (реакция гидратации): H2С=СН2 + Н2О → Н3С—CH2ОН

Правило В.В. Марковникова Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а галоген – к менее гидрогенизированному. H3C—CH=CH2 + H—Br → H3C—CH—CH3 | Br Реакция идет по ионному механизму.

Реакции окисления Горение: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O Окисление перманганатом калия: 3H2C=CH2 + 2KMnO4 + 4H2O → → 3CH2—CH2 + 2MnO2 + KOH | | OH OH Частичное окисление : 350°C, Ag 2Н2С=СН2 + O2 → 2Н2С — СН2 \ / О
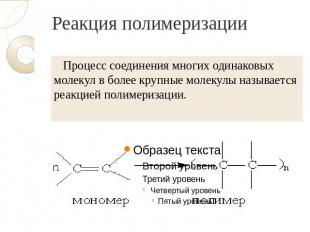
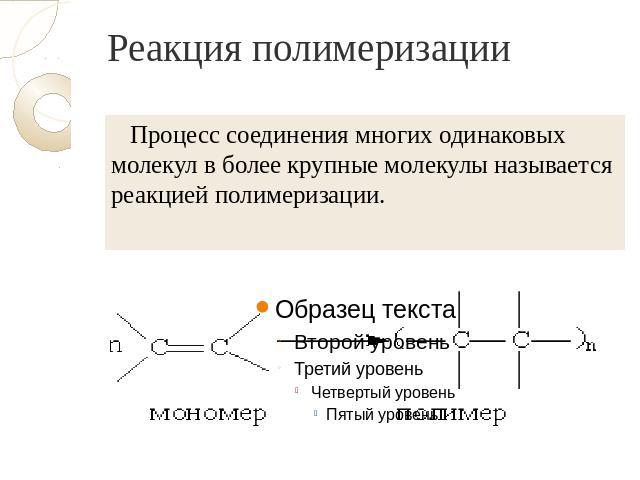
Реакция полимеризации Процесс соединения многих одинаковых молекул в более крупные молекулы называется реакцией полимеризации.

Тестовое задание № 2: 1. Реакция присоединения водорода называется А) гидрирование Б) гидрогалогенирование В) гидратация В) дегидрирование 2. В реакции бромирования пропена образуется А) 1,3-дибромпропан Б) 1-бромпропан В) 2-бромпропан Г) 1,2-дибромпропан 3. Сумма коэффициентов в уравнении горения пропена равно: А) 11 Б) 15 В) 21 Г) 23 4. При гидрогалогенировании алкенов атом водорода присоединяется к … гидрированному атому углерода, а атом галогена – к … гидрированному. А) более Б) менее

Получение алкенов Дегидратация спиртов: H2SO4 H−CH2−CH2−OH → CH2=CH2 + H2O Из галогеналканов: H−CH2−CH2−Br + KOHсп. р-р → СH2=CH2 + KBr + H2O Крекинг алканов: t С8Н18 → С4Н10 + С4Н8 Дегидрирование алканов: t, Cr2O3 H−CH2−CH2−H → CH2=CH2 + H2

Тестовое задание № 3: 1. Бутен можно получить крекингом: А) бутана Б) пентана В) гексана Г) октана 2. Какие признаки характеризуют физические свойства этена: 1) бесцветная жидкость, 2) имеет резкий запах, 3) бесцветный газ, 4) немного легче воздуха, 5) почти без запаха, 6) плохо растворим в воде, 7) не горит, 8) с воздухом образует взрывоопасные смеси? А) 3,4,5,6,8 Б) 1,2,6,7 В) 2,3,4,6,8 Г) 3,4,6,8 3. Плотность паров алкена по водороду равна 49. Массовая доля углерода в нём – 85,71%, массовая доля водорода – 14,29%. Молекулярная формула этого углеводорода А) С5Н10 Б) С6Н12 В) С7Н14 Г) С8Н16

Выводы Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода находятся в состоянии sp2- гибридизации. Общая формула – СnH2n. В названии алкенов используется суффикс –ен. Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами. Алкены обладают большой химической активностью. За счёт наличия π-связи алкены вступают в реакции присоединения, окисления, полимеризации.