Презентация на тему: Физика атома

Презентация по теме«Физика атома»для профильного 11-го классаПодготовила учитель физики МОУ СОШ №43 г.ТвериГрекалова Галина Николаевна

Тема :«Физика атома»

Поурочное планирование Строение атома по Томсону и Резерфорду. Опыт РезерфордаПостулаты Бора. Атомные спектры Атом водорода

Цель: Познакомиться с теорией строения атома и атомного ядра Изучить две модели строения атома, их недостатки в объяснении стабильности и сходства атомов.Выяснить, как постулаты Бора позволяют преодолеть трудности планетарной модели.Изучить строение атома водорода по Бору.

Опыт Резерфорда В начале XX века было экспериментально доказано, что атом состоит из ядра и электронов. Резерфордом в результате опытов по рассеянию α-частиц на тонкой фольге (золото, серебро, медь и др.) была предложена планетарная модель строения атома. Согласно этой модели: атом имеет положительно заряженное ядро, размеры которого малы по сравнению с размерами самого атома; в ядре сконцентрирована почти вся масса атома; электроны вращаются вокруг ядра по орбитам (почти как планеты вокруг Солнца).

Строение атома по Томсону и Резерфорду Планетарная модель атомаАтом – наименьшая частица химического элемента, являющаяся носителем его свойств.Атом состоит из ядра и движущихся вокруг него электронов. Отрицательно заряженные электроны удерживаются вблизи положительно заряженного ядра силами электромагнитного взаимодействия.Электрон – это частица, заряд которой отрицателен и равен по модулю элементарному заряду e = 1,6·10–19 Кл, а масса me = 9,1·10–31 кг.Планетарную модель атома предложил Резерфорд в 1911 году на основании своих исследований.

Компьютерная модель атома водорода Модель атома водорода 11Н. Это самый простой атом. Он состоит из протона и электрона. При поглощении атомом кванта света электрон переходит на более высокую орбиту. При переходе электрона на более низкую орбиту атом излучает квант света. В правом верхнем углу экрана показана схема энергетических уровней атома водорода, на которой стрелками изображены переходы электрона.

Атомное ядро Атомное ядро заряжено положительно. Его диаметр не превышает 10–14–10–15 м, а заряд Q равен произведению элементарного заряда электрона на порядковый номер атома Z в таблице Менделеева: Q = Z·e.В настоящее время доказано, что атомное ядро состоит из протонов и нейтронов, удерживаемых ядерными силами. Протоны и нейтроны носят общее название нуклонов. Протон – это частица, заряд которой положителен и равен по модулю заряду электрона: qp = +1,6·10–19 Кл, а масса mp = 1,6726·10–27 кг. Нейтрон – это нейтральная частица, масса которой равна mn = 1,6749·10–27 кг. Условное обозначение химического элемента позволяет легко определять состав ядра и число электронов в атоме. В ядре атома кислорода 168О находятся 8 протонов и 8 нейтронов

Постулаты Бора

Распределение вероятности нахождения электрона на различных расстояниях от ядра Боровских орбит в атоме в действительности не существует. В каждом состоянии может быть указано только распределение вероятности нахождения электрона на различных расстояниях от ядра, которое называют электронным облаком. Компьютерная модель предназначена для иллюстрации строгого решения задачи о состояниях атома водорода при значениях главного квантового числа n = 1, 2 и 3. При графическом изображении радиальных распределений вероятности удобно в качестве переменной величины использовать безразмерное отношение ρ = r / r1, где r1 = 5,29·10–11 м – радиус первой боровской орбиты.
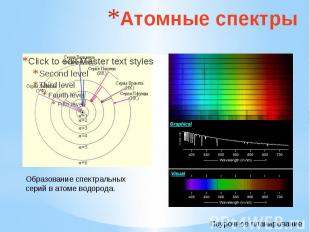
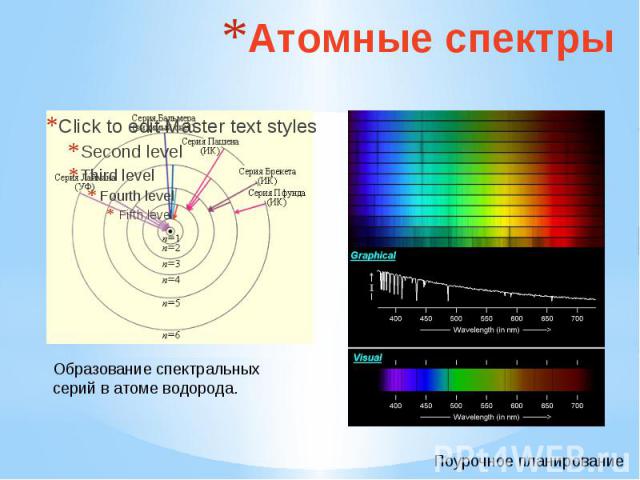
Атомные спектры Образование спектральных серий в атоме водорода.

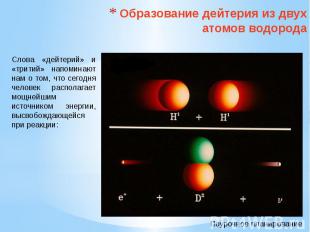
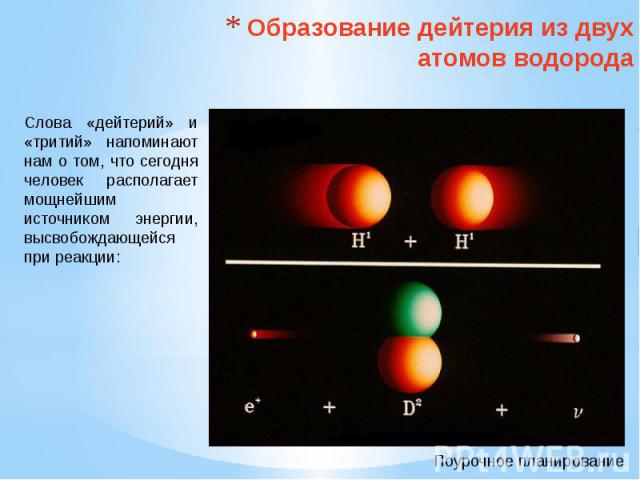
Образование дейтерия из двух атомов водорода Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции:

Спасибо за внимание