Презентация на тему: «Белки, строение и функции»

Б Е Л К И

Жизнь — это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров — белков и нуклеиновых кислот. Основой всего живого считаются нуклеиновые кислоты и белки, так как они функционируют в клетке, образовывают сложные соединения, которые входят в структуру всех живых организмов. Все живые организмы в природе состоят из одинаковых уровней организации, это общая для всех живых организмов характерная биологическая закономерность.

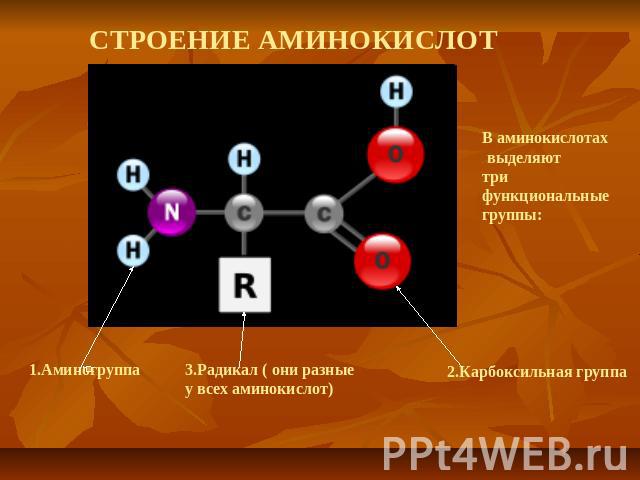
Белки— высокомолекулярные органические соединения – (ВМС), нерегулярные биополимеры, состоящие из мономеров- аминокислот, соединенных пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков.
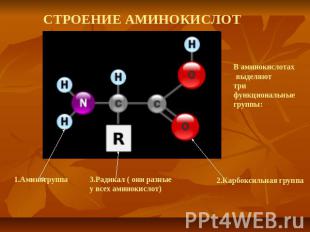
СТРОЕНИЕ АМИНОКИСЛОТ

Незаменимые аминокислоты Не могут быть синтезированы в организме. Поэтому их поступление в организм с пищей необходимо. Незаменимыми для человека и животных являются 8 аминокислот: Валин -зерновые, мясео, грибы, молочные продукты, арахис. Изолейцин - миндаль, кешью, куриное мясо, яйца, рыба, чечевица, печень, мясо. Лейцин – мясо, рыба, рис, чечевица, орехи. Лизин – рыба, мясо, молочные продукты, пшеница, орехи. Метионин - мясо, рыба, яйца, бобы, фасоль, чечевица и соя. Треонин – молочные продукты и яйца, в умеренных количествах в орехах. Триптофан – овес, бананы, сушёные финики, арахис, кунжут, молоко, творог, рыба, курица, индейка, мясо. Фенилаланин - говядина, куриное мясо, рыба, соевые бобы, яйца, творог, молоко.

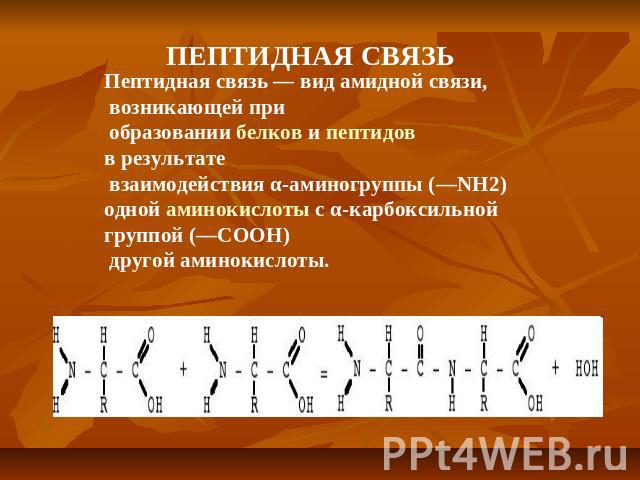
ПЕПТИДНАЯ СВЯЗЬ Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
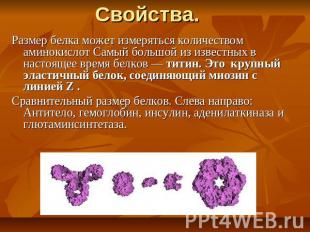
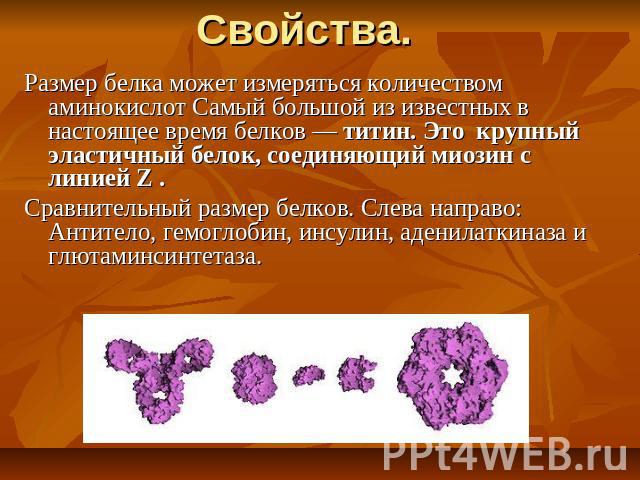
Свойства. Размер белка может измеряться количеством аминокислот Самый большой из известных в настоящее время белков — титин. Это крупный эластичный белок, соединяющий миозин с линией Z . Сравнительный размер белков. Слева направо: Антитело, гемоглобин, инсулин, аденилаткиназа и глютаминсинтетаза.

Денатурация. Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца

Б Е Л К И Простые Состоят только из аминокислотных остатков Сложные могут включать: - ионы металла (металлопротеиды) -пигмент (хромопротеиды), -комплексы с липидами (липопротеины), -нуклеиновые кислоты(нуклеопротеиды), -остаток фосфорной кислоты (фосфопротеиды), -углевод (гликопротеины)
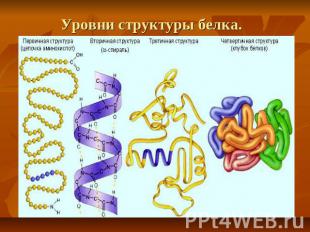
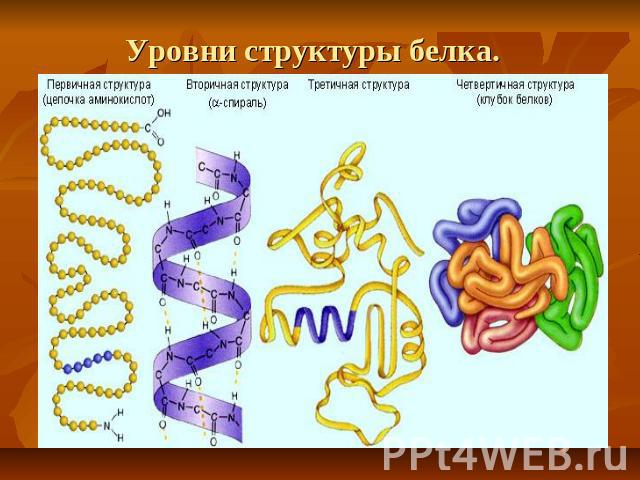
Уровни структуры белка.

Первичная структура — последовательность аминокислот в полипептидной цепи. Определяется и соответствует последовательности нуклеотидов в молекуле ДНК
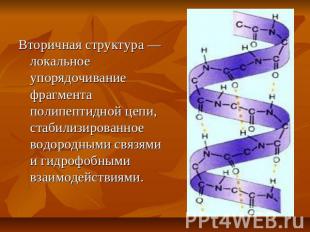
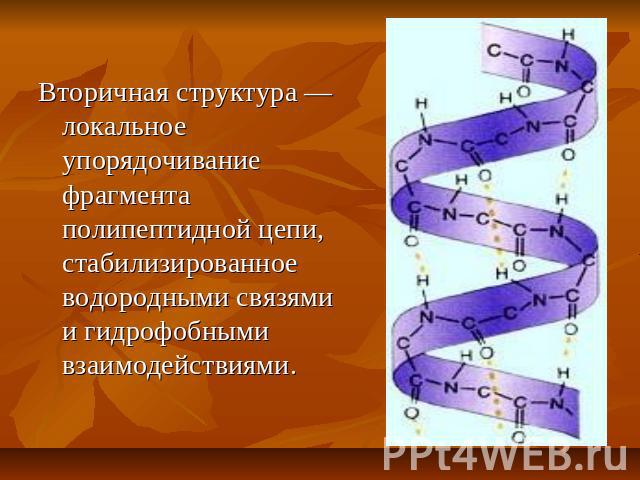
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.

Третичная структура — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие: ковалентные связи; ионные взаимодействия; водородные связи; гидрофобные взаимодействия.
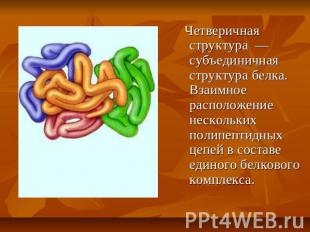
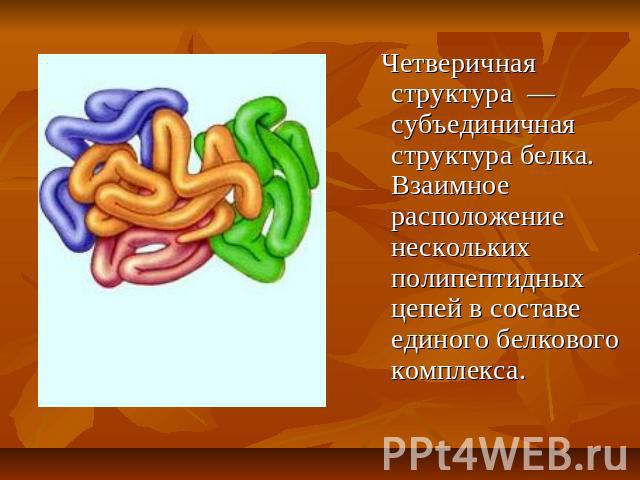
Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.

Функции белков.


ЧТО ОБЩЕГО У ЛЮДЕЙ НА ПРЕДЫДУЩЕМ СЛАЙДЕ? КАК ЭТИ ФОТОГРАФИИ СВЯЗАНЫ С ТЕМОЙ УРОКА?

ИТОГИ УРОКА: 1.Что узнали? 2.Для чего это нужно? 3.Насколько это важно? 4.Как вас изменили эти знания?

Домашнее задание 1.Составить синквейн со словами: белок, аминокислота, радикал. 2.& 3 по учебнику Общая биология: Учеб. Для 10–11 кл. Д.К.Беляев, П.М.Бородин, Н.Н.Воронцов и др. М.