Презентация на тему: тепловой эффект химических реакции

Азот и его соединения Символ - N Атомный вес - 14.0067 Плотность - 0.808 (при -195.8°C) Температура плавления - -209.86 °C Температура кипения - -195.82 °C Открыт - Д. Резерфордом в 1772 г.

Жидкий азот Жидкий азот —не взрывоопасен и не ядовит.

Применение жидкого азота ; для охлаждения различного оборудования и техники; для охлаждения компонентов компьютера при экстремальном разгоне
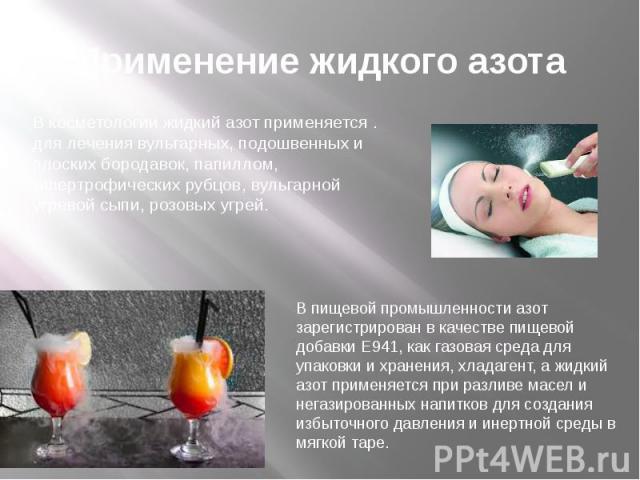
Применение жидкого азота В косметологии жидкий азот применяется . для лечения вульгарных, подошвенных и плоских бородавок, папиллом, гипертрофических рубцов, вульгарной угревой сыпи, розовых угрей.

Поведение веществ в жидком азоте Вещества в жидком азоте становятся хрупкими

Ожоги жидким азотом Следует охладить поражённые участки тела водой или холодными предметами, ввести обезболивающие препараты, наложить на раны повязки из стерильных перевязочных средств или подручных материалов.

Кессонная болезнь Кессонная болезнь возникает при быстром снижении давления (например, при всплытии с глубины, выхода из кессона или барокамеры, или подъеме на высоту). При этом газ азот, ранее растворенный в крови или тканях, образует газовые пузырьки в кровеносных сосудах. Характерные симптомы включают боль или неврологические нарушения. Тяжелые случаи могут быть фатальными.

Химические свойства азота В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи, атомарный же азот химически очень активен. Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид: 6Li + N2 = 2Li3N С повышением температуры активность молекулярного азота увеличивается. При взаимодействии азота с водородом при нагревании, повышенном давлении и присутствии катализатора образуется аммиак: N2 + 3H2 = 2NH3 С кислородом азот соединяется только в электрической дуге с образованием оксида азота (II): N2 + O2 = 2NO
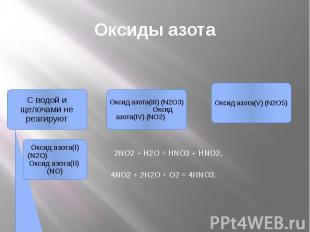
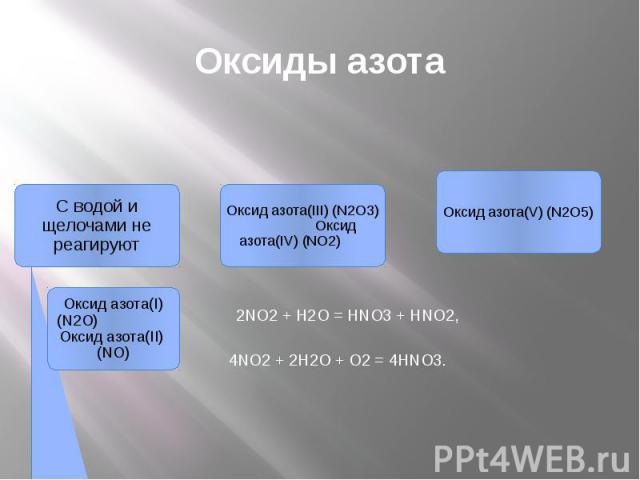
Оксиды азота

Азотная кислота Температура кипения азотной кислоты +83 °С, температура замерзания –41 °С, т.е. при обычных условиях это жидкость. Резкий запах и то, что при хранении она желтеет, объясняется тем, что концентрированная кислота малоустойчива и под действием света или при нагревании частично разлагается. 4HNO3 = 2H2O + 4NO2 + O2.

Взаимодействие с металлами Концентрированная азотная кислота Me + HNO3(конц.) → соль + вода + NO2 С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑.

Взаимодействие с металлами Разбавленная азотная кислота Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции: Активный металл 8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3 Металл средней активности 10Cr + 36HNO3(разб.) → 10Cr(NO3)3 + 18H2O + 3N2 Металл малоактивный 3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO

Получение азотной кислоты NaNO3 + H2SO4 = NaHSO4 + HNO3

Применение азотной кислоты Производство азотных и комплексных удобрений. Производство взрывчатых веществ. Производство красителей. Производство лекарств. Производство пленок, нитролаков, нитроэмалей. Производство искусственных волокон. Как компонент нитрующей смеси, для траления металлов в металлургии.

Аммиак .

Аммиак - опасен В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного

Получение аммиака лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O

Химические свойства аммиака NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O

Взаимодействие аммиака с водой и кислотами И водный раствор аммиака, и соли аммония содержат особый ион — катион аммония NH4, играющий роль катиона металла. Он получается в результате того, что атом азота имеет свободную (неподеленную) электронную пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды: Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным.

Соли аммония вступают в обменную реакцию с кислотами и солями: (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3 (NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑ взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония: NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O разлагаются при нагревании NH4Cl → NH3↑ + HCl