Презентация на тему: Физические свойства воды

2 900igr.net
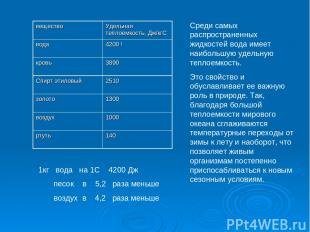
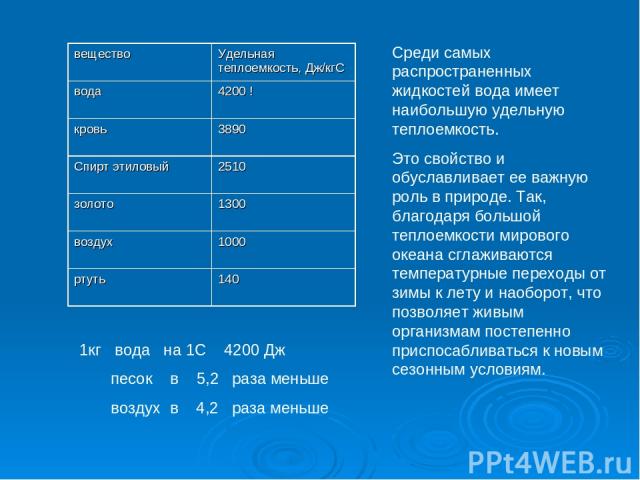
1кг вода на 1С 4200 Дж песок в 5,2 раза меньше воздух в 4,2 раза меньше Среди самых распространенных жидкостей вода имеет наибольшую удельную теплоемкость. Это свойство и обуславливает ее важную роль в природе. Так, благодаря большой теплоемкости мирового океана сглаживаются температурные переходы от зимы к лету и наоборот, что позволяет живым организмам постепенно приспосабливаться к новым сезонным условиям. вещество Удельная теплоемкость, Дж/кгС вода 4200 ! кровь 3890 Спирт этиловый 2510 золото 1300 воздух 1000 ртуть 140

Вода стоит на первом месте среди веществ, которые входят в состав клетки, что способствует поддержанию стабильности температуры тела живых организмов. Человек на 2/3 своей массы (60%) состоит из воды. Чем объяснить, что из известных нам 110 химических элементов в состав клеток живых организмов входят только 24: водород- 60% кислород – 255 С – 10% N, Са, Р, Сl, S, Nа, Мg… – 3%.

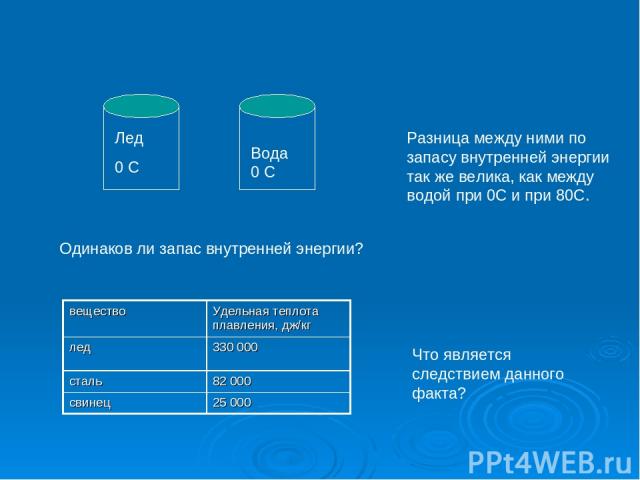
Лед 0 С Вода 0 С Одинаков ли запас внутренней энергии? Разница между ними по запасу внутренней энергии так же велика, как между водой при 0С и при 80С. Что является следствием данного факта? вещество Удельная теплота плавления, дж/кг лед 330 000 сталь 82 000 свинец 25 000

То, что у воды рекордно большая, по сравнению с другими веществами, удельная теплота замерзания, приводит к тому, что водная поверхность не «спешит» одеваться льдом при первых заморозках, но и не «торопится» сбросить ледяной панцирь в самом начале весны. Этим можно объяснить то факт, что во время весеннего ледохода у реки прохладно, а во время снегопада – тепло.
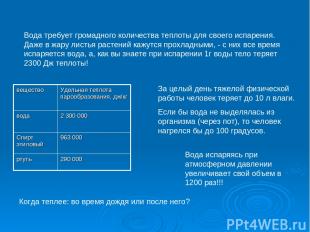
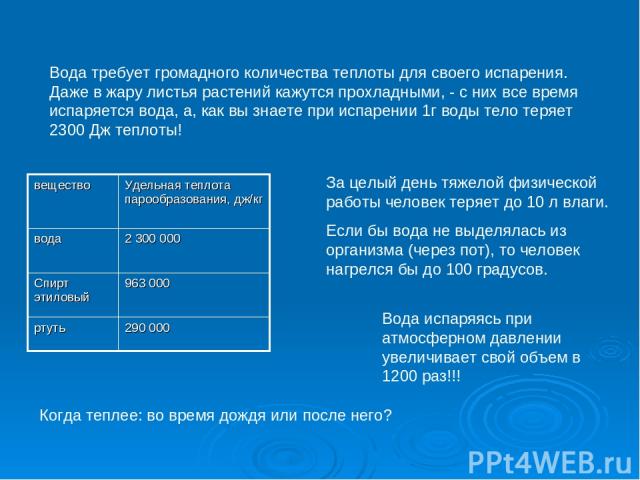
Вода требует громадного количества теплоты для своего испарения. Даже в жару листья растений кажутся прохладными, - с них все время испаряется вода, а, как вы знаете при испарении 1г воды тело теряет 2300 Дж теплоты! За целый день тяжелой физической работы человек теряет до 10 л влаги. Если бы вода не выделялась из организма (через пот), то человек нагрелся бы до 100 градусов. Когда теплее: во время дождя или после него? Вода испаряясь при атмосферном давлении увеличивает свой объем в 1200 раз!!! вещество Удельная теплота парообразования, дж/кг вода 2 300 000 Спирт этиловый 963 000 ртуть 290 000

Аномально и изменение плотности воды. Плотность других жидкостей, как правило, при понижении температуры постепенно возрастает и становится максимальной при замерзании. А плотность воды при охлаждении «нормально» возрастает лишь до +4С, достигая 1г/куб см. От 4 градусов Цельсия до 0 – она уменьшается. Плотность же льда резко, скачком уменьшается до 0,9г/куб.см.Это имеет очень большое значение в жизни природы. При охлаждении пресных водоемов зимой, по мере понижения температуры поверхностных слоев более плотные массы воды опускаются вниз, а на их место поднимаются снизу теплые и менее плотные. Так происходит до тех пор, пока вода в глубинных слоях не достигнет температуры 4 градусов. При этом конвекция прекращается, т.к. внизу находится более тяжелая вода. Дальнейшее охлаждение воды происходит только с поверхности, чем и объясняется образование льда в поверхностном слое водоемов. Благодаря этому подо льдом не прекращается жизнь, т.к. водоем не промерзает полностью.

Что мы знаем о воде? Вода Н2О Наибольшая теплоёмкость С = 4200 Дж/кг С среди жидкостей Бесцветна, без запаха Плотнее чем лёд удельная теплота парообразования удельная теплота отвердевания

Строение молекулы воды. О О )!105 Н Н - Н + О * * Н Н диполь НО 2 В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула воды нелинейна; угол между связями О – Н равен примерно 105 градусов. Связи эти не только ковалентны, но и полярны. Атомы Н несут на себе некоторый положительный заряд, атомы О – отрицательный. Поэтому и полярна молекула в целом; она представляет собой диполь.

Дипольные молекулы взаимодействуют сильнее, чем молекулы неполярные. Но молекулы воды связаны между собой гораздо прочнее, чем можно было ожидать, учитывая лишь физическое взаимодействие диполей. Это объясняется существованием водородных связей. В водородной связи участвуют атом О одной молекулы и атом Н – другой. Такие связи гораздо менее прочны(в15- 20 раз) чем ковалентные, и все же именно благодаря им взаимодействие молекул в воде гораздо сильнее, чем во многих других жидкостях. Н Н . . . Н О Н О

Молекулярная структура агрегатного состояния воды(жидкость) Именно повышенная прочность связей между молекулами Н2О служит причиной аномально высокой температуры кипения воды. Сильное межмолекулярное взаимодействие затрудняет переход молекул из жидкости в пар. Поскольку тепловая энергия при нагревании воды расходуется не только на ускорение движения молекул воды, но и на разрыв водородных связей между ними, то теплоемкость воды оказывается столь большой.

С высокой полярностью молекул воды связано большое значение ее диэлектрической проницаемости и почти не имеющая себе равных способность растворять другие полярные соединения и вызывать электролитическую диссоциацию кислот, оснований и солей. вещество вода 81 Спирт этиловый 25 бензин 2

Строение льда. В кристаллах льда также существуют водородные связи. Но здесь система таких связей статична, а следовательно, еще более прочна, чем в жидкой воде. В этом причина аномально высокой температуры плавления и удельной теплоты плавления льда. В кристаллах льда каждая молекула воды соединена водородными связями с четырьмя соседними. Такая структура ажурна – в ней много «пустот». Вот почему плотность льда сравнительно низка. При плавлении льда часть «пустот» заполняется «одиночными» и «сдвоенными» молекулами Н О, уже освободившимися из кристаллической решетки. Поэтому плотность воды выше, чем у льда. Объем льда на 10% больше объема воды. 2

Существование воды на нашей планете в трех агрегатных состояниях – газообразном, жидком и твердом – обязано одному важному счастливому обстоятельству: вращению Земли вокруг Солнца на среднем расстоянии 150 млн км. Если бы путь от Земли до Солнца составлял менее 134 млн км, то вся вода океанов, морей и рек испарилась бы. Увеличение расстояния между Землей и Солнцем более чем на 166 млн км привело бы к исчезновению жидкой воды на нашей планете – она полностью превратилась бы в лед.