Презентация на тему: імунопатогенез міастенії


аутоімунне захворювання, при якому антитіла ушкоджують і руйнують рецептори до ацетилхоліну в поперечно –посмугованій мускулатурі . Наявне порушення нейром'язової провідності викликає слабкість і крихкість скелетної мускулатури, але не уражає серцеву та гладком'язову тканину . аутоімунне захворювання, при якому антитіла ушкоджують і руйнують рецептори до ацетилхоліну в поперечно –посмугованій мускулатурі . Наявне порушення нейром'язової провідності викликає слабкість і крихкість скелетної мускулатури, але не уражає серцеву та гладком'язову тканину .

Перша згадка про міастенії зустрічається в літописах Virginian, в 1664 році: " надмірна втома , з якою він зіткнувся, руйнувала його конституцію ; його плоть стала розмоченою ; його сухожилля втратили свій тонус і еластичність ; і його повіки були настільки важкі, що він не міг бачити, якби вони не були підняті його прислугою ... він був не здатний йти ; але його дух височів вище руїн його тіла " . Перша згадка про міастенії зустрічається в літописах Virginian, в 1664 році: " надмірна втома , з якою він зіткнувся, руйнувала його конституцію ; його плоть стала розмоченою ; його сухожилля втратили свій тонус і еластичність ; і його повіки були настільки важкі, що він не міг бачити, якби вони не були підняті його прислугою ... він був не здатний йти ; але його дух височів вище руїн його тіла " . Клінічний опис міастенії вперше був даний англійською лікаркою T.Willis у 1672 р. У 1970 р. вперше була продемонстрована ефективність лікування преднізолоном.
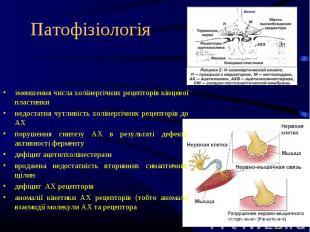
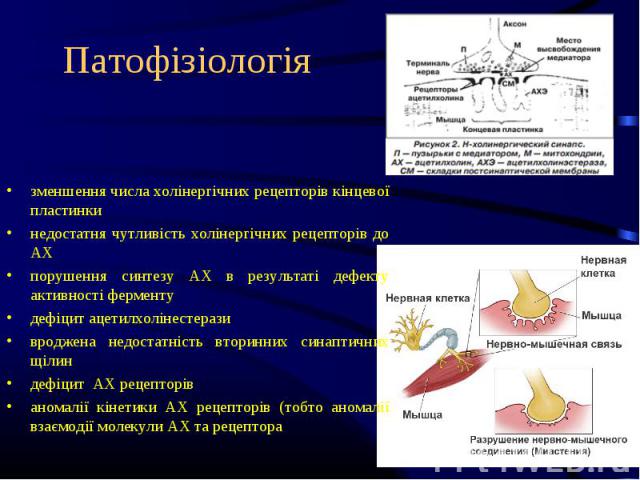
зменшення числа холінергічних рецепторів кінцевої пластинки недостатня чутливість холінергічних рецепторів до АХ порушення синтезу АХ в результаті дефекту активності ферменту дефіцит ацетилхолінестерази вроджена недостатність вторинних синаптичних щілин дефіцит АХ рецепторів аномалії кінетики АХ рецепторів (тобто аномалії взаємодії молекули АХ та рецептора
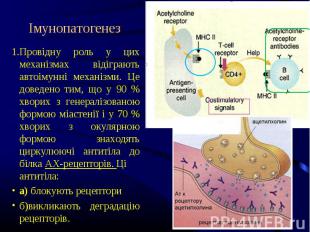
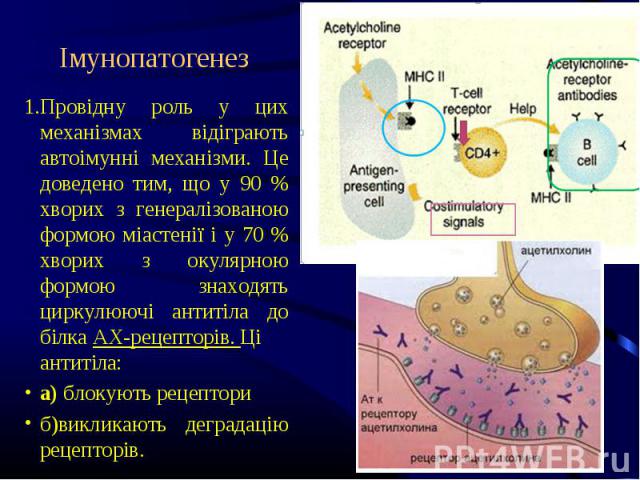
Провідну роль у цих механізмах відіграють автоімунні механізми. Це доведено тим, що у 90 % хворих з генералізованою формою міастенії і у 70 % хворих з окулярною формою знаходять циркулюючі антитіла до білка АХ-рецепторів. Ці антитіла: Провідну роль у цих механізмах відіграють автоімунні механізми. Це доведено тим, що у 90 % хворих з генералізованою формою міастенії і у 70 % хворих з окулярною формою знаходять циркулюючі антитіла до білка АХ-рецепторів. Ці антитіла: а) блокують рецептори б)викликають деградацію рецепторів.

Полісистемність захворювання (часто страждає сполучна тканина, щитоподібна залоза) Полісистемність захворювання (часто страждає сполучна тканина, щитоподібна залоза) Часте поєднання з колагенозом (СЧВ, хвороба Шегрена, поліміозит) Можливість спровокувати захворювання на тваринах, шляхом введення їм імуноглобулінів хворрого Можливість передачі від матері до плода під час вагітності Позитивний результат від лікування кортикостероїдами. Запуск аутоалергічного процесу виникає в результаті: а) генетичної схильності до порушень імунної системи; б) внаслідок вірусного ураження тімуса, що призводить до продукції Т-лімфоцитів із зміненими мембранними структурами.

Доведено, що у хворих з гені­рализованной формою МГ в 80-90% випадків виявляються антитіла до нікотинчутливих ацетилхо­линовим рецепторам. Підтвердженням того, що анти­тіла блокують нервово-м'язову передачу, служить факт, що однотипні антитіла виявляють у хворих МГ і у тварин з експериментальною аутоим­мунной МГ. Доведено, що у хворих з гені­рализованной формою МГ в 80-90% випадків виявляються антитіла до нікотинчутливих ацетилхо­линовим рецепторам. Підтвердженням того, що анти­тіла блокують нервово-м'язову передачу, служить факт, що однотипні антитіла виявляють у хворих МГ і у тварин з експериментальною аутоим­мунной МГ. Нещодавно було встановлено, що існує декілька типів ауто- AChR антитіл. Одні мають здатність прискорювати деградацію AChR, інші - блокувати їх. Це пояснює властивістю антитіл зв'язувати різні епитопина поверхні AChR. Проте переважна кількість антитіл у хворих МГ осідає на постсинаптичній мембрані, а не на самих AChR.

У 3-10% хворих МГ не виявляються антитіла до AChR. Проте доказом ролі антитіл в цих випадках також можна введенням сироватки хворих експериментальним тваринам, індукуючи у них МГ. Показана роль ауто- AChR антитіл в індукції м'язової деградації у хворих з МГ. Таким чином, антитіло-негативна МГ насправді являється антитіло-індукованим аутоімунним захворюванням. У 3-10% хворих МГ не виявляються антитіла до AChR. Проте доказом ролі антитіл в цих випадках також можна введенням сироватки хворих експериментальним тваринам, індукуючи у них МГ. Показана роль ауто- AChR антитіл в індукції м'язової деградації у хворих з МГ. Таким чином, антитіло-негативна МГ насправді являється антитіло-індукованим аутоімунним захворюванням.

Встановлено, що ці антитіла зменшують кількість AChR за допомогою трьох різних механізмів: Встановлено, що ці антитіла зменшують кількість AChR за допомогою трьох різних механізмів: прискоренням эндоцитозу і деградації AChR; функциональною блокадою сайтів для зв'язування ацетілхоліну на самих рецепторах; комплементзалежним пошкодженням AChR

Встановлено, що тимичені порушення чітко асоціюються з МГ, але природа цих зв'язків не визначена. Встановлено, що тимичені порушення чітко асоціюються з МГ, але природа цих зв'язків не визначена. У гермінативних центрах гіперплазованих тимусів хворих МГ виявляються формування епітеліальними клітинами тимуса комплексів з экспресією в них імуногенного α-ланцюга AChR призводить до виникнення тимогенной міастенії. Описаний ряд ультраструктурных змін у вилочковой залозі хворих МГ, що характеризують виражену запальну реакцію з підвищеним вмістом нейтрофілів і макрофагів, гіперплазією епітеліальних клітин тимуса і формуванням нових герминативных центрів, що не спостерігається в тимусах здорових осіб .

Склад сироваткових імуноглобулінів в крові різних хворих неоднаковий. У частини пацієнтів виявляють гіпогаммаглобулінемію, тобто, можливо, в генезі МГ лежить імунодефіцит. Проте у більшості хворих зміст імуноглобулінів знаходиться в нормі або трохи підвищений, але всі антитіла, викликаючі МГ, зазвичай поліклональні. Описані випадки і моноклональної гаммапатії при МГ. Середній рівень IgG у деяких хворих МГ злегка підвищений, уровеньIgM в сироватці крові найчастіше знижений, у окремих хворих значно. Понижений у хворих МГ і рівень IgA, особливо при тимомогенних формах. Це може служити непрямим свідченням недостатності функції тимуса при МГ. Склад сироваткових імуноглобулінів в крові різних хворих неоднаковий. У частини пацієнтів виявляють гіпогаммаглобулінемію, тобто, можливо, в генезі МГ лежить імунодефіцит. Проте у більшості хворих зміст імуноглобулінів знаходиться в нормі або трохи підвищений, але всі антитіла, викликаючі МГ, зазвичай поліклональні. Описані випадки і моноклональної гаммапатії при МГ. Середній рівень IgG у деяких хворих МГ злегка підвищений, уровеньIgM в сироватці крові найчастіше знижений, у окремих хворих значно. Понижений у хворих МГ і рівень IgA, особливо при тимомогенних формах. Це може служити непрямим свідченням недостатності функції тимуса при МГ.

Специфічною ознакою міастенії є патологічна м’язова втомлюваність. М’язова слабкість при міастенії відрізняється від звичайних парезів тим, що при повторенні рухів м’язова слабкість наростає і може досягнути ступеня повного паралічу. Специфічною ознакою міастенії є патологічна м’язова втомлюваність. М’язова слабкість при міастенії відрізняється від звичайних парезів тим, що при повторенні рухів м’язова слабкість наростає і може досягнути ступеня повного паралічу. Дебютує захворювання, в більшості випадків, у віці 20-30 років (частіше у жінок), хоча може виникати і у дитячому віці (частіше у хлопчиків), і в пубертатному періоді та в 65-75 років (однаково у жінок і чоловіків). Частіше хворіють жінки. У похилому віці частіше хворіють чоловіки, причому у них нерідко виявляють тімому. Захворювання розвивається частіше підгостро і хронічно, хоча бувають випадки гострого розвитку (при інфекціях, інтоксикаціях, ендокринних зсувах (клімакс, вагітність)).

бульбарна бульбарна скелетна генералізована
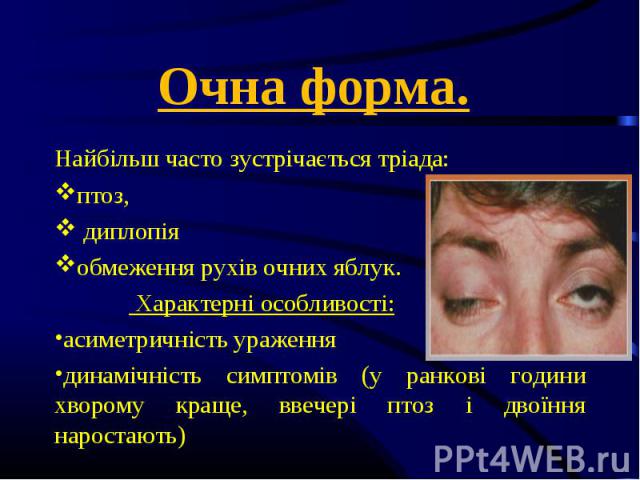
Найбільш часто зустрічається тріада: Найбільш часто зустрічається тріада: птоз, диплопія обмеження рухів очних яблук. Характерні особливості: асиметричність ураження динамічність симптомів (у ранкові години хворому краще, ввечері птоз і двоїння наростають)

Неонатальна - у дітей, що народились у матерів, хворих на міастенію у результаті переходу антитіл через плаценту; Неонатальна - у дітей, що народились у матерів, хворих на міастенію у результаті переходу антитіл через плаценту; Клініка – гіпотонія м’язів, слабкий крик, слабке ссання, поверхневе і часте дихання, с-м “млявої дитини”. Терапевтичний ефект наступає від антихолінестеразних препаратів. Явища минають через 4-6 тижнів. Вроджена - діти народжені у здорових матерів. Клініка – така ж сама. Лікування малоефективне (антихолінестеразні препарати, плазмаферез і хірургічне лікування). Рання дитяча міастенія - Розвивається в 1-2 річному віці, перебіг – м’який. В основному у вигляді очної форми. Ювенільна. Найчастіша. Перші симптоми з’являються у 11-16 років, в основному у дівчаток. Генералізована форма переважає.
Фармакологічна Фармакологічна Електрофізіологічна Імунологічна

Прозеринова проба. Прозерин в дозі 1,5-3 мл 0,05 % вводять п/ш. Можна разом з атропіном (1мг), щоб не було побічних ефектів. Прозерин може дати побічну дію (брадикардія, бронхоспазм, артеріальна гіпотензія). При введенні прозерину може виникати гіперсалівація, сльозотеча, фасцикуляції, діарея, кишкова колька, нудота, нетримання сечі і калу. Прозеринова проба. Прозерин в дозі 1,5-3 мл 0,05 % вводять п/ш. Можна разом з атропіном (1мг), щоб не було побічних ефектів. Прозерин може дати побічну дію (брадикардія, бронхоспазм, артеріальна гіпотензія). При введенні прозерину може виникати гіперсалівація, сльозотеча, фасцикуляції, діарея, кишкова колька, нудота, нетримання сечі і калу. Через 20-40 хвилин – регрес усіх симптомів. А через 2-3 годин – все повертається на свої місця. При очній формі проба малоінформативна

ЕМГ – міастенічна реакція, міастенічне виснаження (яке полягає у прогресуючому зниженні амплітуди М-відповіді більше, ніж на 10-15 %. Проба (+) у 85 % хворих скелетною формою і у 10 % з очною формою. ЕМГ – міастенічна реакція, міастенічне виснаження (яке полягає у прогресуючому зниженні амплітуди М-відповіді більше, ніж на 10-15 %. Проба (+) у 85 % хворих скелетною формою і у 10 % з очною формою.

Виявлення антитіл до ацетилхолінових рецепторів Виявлення антитіл до ацетилхолінових рецепторів

неврастенія неврастенія міастенічний синдром Ламберта-Ітона ботулізм БАС полінейропатія м’язові дистрофії запальні міопатії інсульт у в/б басейні пухлина стовбура головного мозку

Антихолінестеразні препарати Антихолінестеразні препарати Tимектомія Кортикостероїди Iмуносупресивна терапія Плазмофорез Імуноглобуліни Променева терапія тимуса

калімін 30 мг тричі за день, поступово можна дозу збільшувати до 60-120 мг (приймати під час їжі). Ефект настає через 10-30 хвилин, досягає максимуму через 2 години і триває ще 2 години. Побічні дії: нудота, болі в животі, діарея. В загальному дія каліміну може тривати до 6-8 годин. Діє в основному на краніальні м’язи (а тому показаний при очній і бульбарній формах) калімін 30 мг тричі за день, поступово можна дозу збільшувати до 60-120 мг (приймати під час їжі). Ефект настає через 10-30 хвилин, досягає максимуму через 2 години і триває ще 2 години. Побічні дії: нудота, болі в животі, діарея. В загальному дія каліміну може тривати до 6-8 годин. Діє в основному на краніальні м’язи (а тому показаний при очній і бульбарній формах) прозерин по 0,5-1,5 мг п/ш (його дія нетривала – 2-3 години) оксазил - по 5 мг per oss. Дія триває 4-8 годин на скелетні м’язи.

Призначають при недостатній ефективності антихолінестеразних препаратів. Гормони ефективні у 70-90 % хворих. Доза: починати слід з 15-20 мг/добу, поступово збільшуючи дозу на 5 мг кожні 2-3 дні, досягаючи дози 50-60 мг/добу. Після стабілізації стану дозу можна зменшувати на 10 мг кожного місяця до 20-30 мг, а потім темп зниження дози зменшують (2,5–5 мг кожних 1-2 місяці). Підтримуюча доза 5-20 мг через день приймається протягом багатьох років, навіть, якщо хвороба протікає асимптомно протягом 1-2 років. Інша схема: схема великих доз: одразу дати в дозі 1-1,5 мг/кг ваги до досягнення ефекту (через день), а потім зменшувати поступово по ½ табл. до підтримуючої дози. Побічні дії: депресія, остеопороз, реактивація туберкульозу, шлунково-кишкова кровотеча. Призначають при недостатній ефективності антихолінестеразних препаратів. Гормони ефективні у 70-90 % хворих. Доза: починати слід з 15-20 мг/добу, поступово збільшуючи дозу на 5 мг кожні 2-3 дні, досягаючи дози 50-60 мг/добу. Після стабілізації стану дозу можна зменшувати на 10 мг кожного місяця до 20-30 мг, а потім темп зниження дози зменшують (2,5–5 мг кожних 1-2 місяці). Підтримуюча доза 5-20 мг через день приймається протягом багатьох років, навіть, якщо хвороба протікає асимптомно протягом 1-2 років. Інша схема: схема великих доз: одразу дати в дозі 1-1,5 мг/кг ваги до досягнення ефекту (через день), а потім зменшувати поступово по ½ табл. до підтримуючої дози. Побічні дії: депресія, остеопороз, реактивація туберкульозу, шлунково-кишкова кровотеча.

азатіопрін призначають при генералізованій та бульбарній формах, коли хворі не переносять кортикостероїдів. Доза: від 50 мг/добу до 150-200 мг/добу. Клінічно ефект настає через 1,5-3 міс від початку призначення і досягає максимуму до 1 року. На фоні прийому препарату вдається знизити дозу прозерину та преднізолону. азатіопрін призначають при генералізованій та бульбарній формах, коли хворі не переносять кортикостероїдів. Доза: від 50 мг/добу до 150-200 мг/добу. Клінічно ефект настає через 1,5-3 міс від початку призначення і досягає максимуму до 1 року. На фоні прийому препарату вдається знизити дозу прозерину та преднізолону.

Плазмаферез при гострому прогресуючому перебігу. Променева терапія тімуса показана хворим похилого віку, після тімектоміїї (неповної), перед операцією тімектомії